HTLV-1感染が引き起こす神経障害HAMの「新・犯人」を特定 ー難治性の神経疾患「HTLV-1関連脊髄症」に対する新たな治療標的を発見ー
- ヘッドライン
- 記者発表
聖マリアンナ医科大学
東京大学大学院新領域創成科学研究科
研究概要
聖マリアンナ医科大学 脳神経内科/難病治療研究センター(山野嘉久主任教授、新谷奈津美助教ら)および東京大学大学院新領域創成科学研究科(山岸誠准教授ら)の研究グループは、神経難病「HTLV-1関連脊髄症(HAM)」において、HTLV-1に感染したT細胞がウイルスの働きによって神経再生阻害因子であるRGMa(Repulsive Guidance Molecule A)を発現し、神経細胞に障害を引き起こすメカニズムを明らかにしました。本研究成果は、HTLV-1がどのようにして神経障害を引き起こすのかという分子機構を初めて解明したものであり、RGMaを標的とした新しいHAM治療法の可能性を示す重要な一歩となります。本研究は、国際医学雑誌『JCI Insight』に2025年6月9日に掲載されました。
成果のポイント
- 難治性の神経疾患「HTLV-1関連脊髄症(HAM)」の発症に、神経の再生を妨げる分子「RGMa」が関与していることを初めて明らかにしました
- HAM患者ではHTLV-1感染細胞がウイルスの働きでRGMaを異常に発現し、神経細胞を障害していることを実験的に証明しました
- RGMaの働きを抑える中和抗体によって、神経障害を軽減できる可能性を提示しました
- 将来的なHAMの治療法開発に向けた基盤となる発見です
本研究の背景
ヒトT細胞白血病ウイルス1型(HTLV-1)は、CD4+T細胞に感染するレトロウイルスであり、成人T細胞白血病(ATL)やHTLV-1関連脊髄症(HAM)を引き起こすことで知られています。HAMは、HTLV-1に感染した免疫細胞が脊髄に浸潤し、進行性の神経障害を引き起こす難治性の神経炎症性疾患です。患者は運動機能の低下、感覚障害、排尿・排便障害などの症状を呈し、進行すると車椅子や寝たきりの生活を余儀なくされます。HAMが疾患として認識されてから約40年が経過しましたが、感染細胞がどのように神経細胞を障害しているのかという分子レベルでのメカニズムは依然として不明であり、根本的な治療法の確立には至っていません。
研究内容
研究グループはまず、HAM患者由来の末梢血単核細胞(HAM-PBMC)が神経細胞に障害を与えることを確認し、この障害にHTLV-1感染細胞が関与していることを明らかにしました。
次に、HTLV-1感染細胞であるCD4+T細胞における発現遺伝子を網羅的に解析したところ、HAM患者のCD4+T細胞では中枢神経再生阻害因子であるRepulsive Guidance Molecule a (RGMa)が特異的に高発現していることを発見しました。RGMaは本来、発生期における神経回路形成に関わる膜タンパク質ですが、近年では神経細胞の生存や再生の阻害因子としても注目されており、脊髄損傷や多発性硬化症などでも病態に関与すると報告されています。
重要なことに、HTLV-1由来のタンパク質である Taxの発現を誘導することで、RGMaの発現が上昇することが実験的に確認されました。加えて、TaxがHAM感染細胞にRGMaを誘導するメカニズムについて詳細な解析を行ったところ、HAM患者の感染細胞では、RGMaの遺伝子発現を調節するDNA領域において、転写抑制に関わるヒストン修飾(H3K27me3)が減少しており、恒常的にRGMa遺伝子の発現が起こりやすくなっていることが明らかになりました。また、このような脱修飾がおこっているDNA領域近傍に対してTaxは内在性の転写因子Sp1を介してアクセスし、RGMa遺伝子の転写活性化にはたらくことで、その発現を誘導することが判明しました(図1)。
最後に、RGMaの働きを中和する抗体(Unasnemab)を用いた実験では、HAM患者の免疫細胞によって生じた神経細胞への障害作用が有意に軽減されることが示されました。これにより、HAM免疫細胞による神経障害にはRGMaが関与していることが示唆されました(図2)。
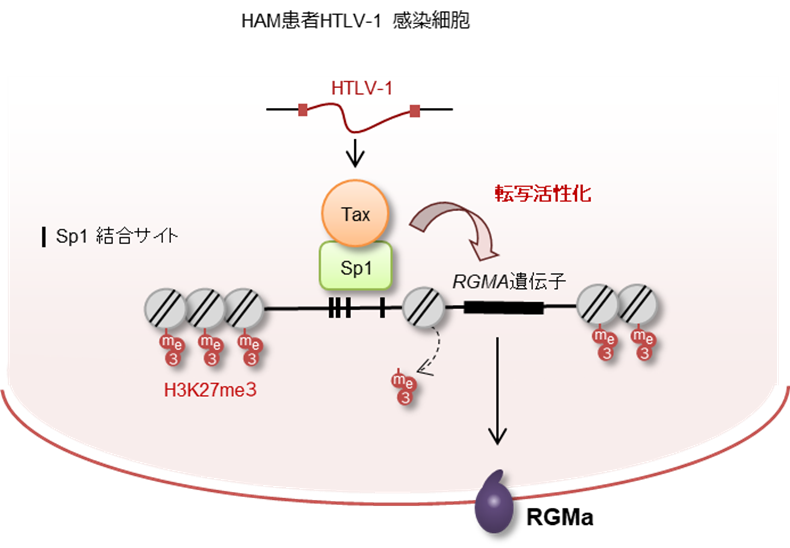
図1. HAMのHTLV-1感染細胞におけるRGMa発現誘導メカニズム
HAMの感染細胞では、RGMa遺伝子の発現を調節するDNA領域においてヒストンH3K27me3(転写抑制性修飾)が解除されています。その結果、RGMa発現調節領域付近にTaxが転写因子Sp1を介してアクセスすることでRGMaの転写を活性化し、感染細胞における発現を誘導していると考えられます。
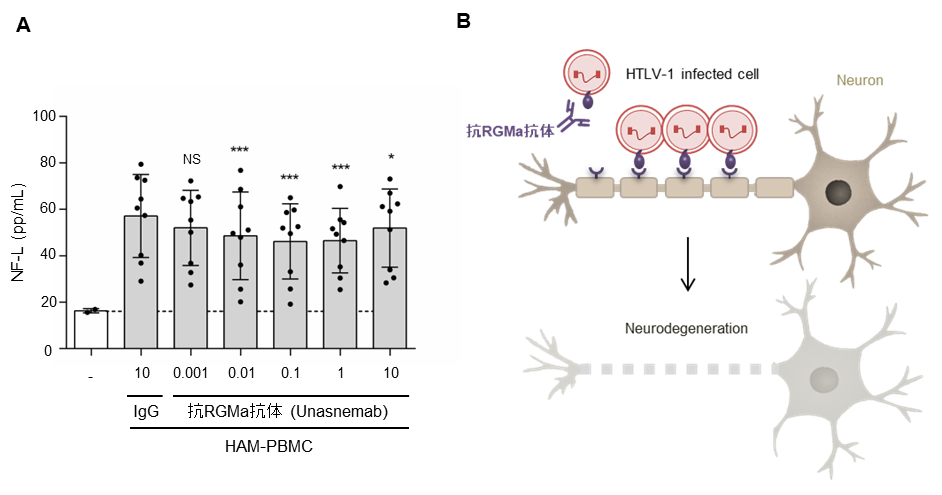
図2. HTLV-1感染細胞に発現するRGMaを介した神経障害作用
(A) 神経細胞株NB-1にHAM-PBMCを添加すると神経障害が観察される。そこに、抗RGMa抗体(Unasnemab)を添加すると、HAM-PBMCによる神経障害作用の減弱が認められた。神経障害は、破壊された神経細胞より放出されるニューロフィラメントL(NF-L)の培養液中の濃度変化により評価した。(B) HTV-1感染細胞に発現したRGMaを介した直接的な神経障害作用のイメージ。
結論と意義
本研究により、HAM患者のHTLV-1感染細胞では、エピジェネティックな変化によりTaxタンパク質がRGMaの発現調節領域にアクセスしやすい状態になっており、HAM特異的なRGMaの発現上昇を引き起こしていることがわかりました。また、HAM患者のHTLV-1感染細胞がRGMaを介して直接的に神経細胞の障害を引き起こしており、RGMaの働きを抑えることで神経障害を軽減できる可能性が示されました。今後は、RGMaを標的とした治療薬の開発が進めば、HAMの進行を抑える新たな選択肢となることが期待されます。
今後の展望
本研究では、HAMにおける神経障害の仕組みの一端を解明することができました。RGMaを標的とした中和抗体(MT-3921)による第I相臨床試験がHAM患者を対象に進行中です。今回の研究成果は、HAMの神経障害の分子基盤の解明と治療法開発の両面に貢献するものといえます。
用語解説
- HTLV-1:主にCD4+T細胞に感染するレトロウイルスの一種であり、成人T細胞白血病(ATL)やHTLV-1関連脊髄症(HAM)などの疾患を引き起こすウイルス
- Tax:HTLV-1から発現するウイルス由来のタンパク質で、ウイルスの複製や持続感染を助けるとともに、宿主細胞のシグナル伝達や遺伝子発現を活性化させます。このはたらきにより、細胞のがん化や炎症反応に関与し、HTLV-1関連疾患の発症に重要な役割を果たす。
- 転写因子:DNA上の特定の配列(プロモーターやエンハンサーなど)に結合して、遺伝子の発現を調節するタンパク質
- ヒストンH3K27me3:ヒストンを構成するタンパク質H3の27番目のリシン残基(K)がトリメチル化される修飾。遺伝子発現を抑制する。
論文情報
掲載誌: JCI Insight
論文タイトル:
Virus-induced RGMa expression drives neurodegeneration in HTLV-1-associated myelopathy
掲載日: 2025年6月9日
著者: 新谷奈津美、山岸誠、中島誠、浅原尚美、清原和裕、荒谷聡子、八木下尚子、堀部恵理香、石崎伊純、渡邉俊樹、佐藤知雄、内丸薫、山野嘉久(責任著者)
DOI:10.1172/jci.insight.184530.
研究助成
本研究は主に、国立研究開発法人日本医療研究開発機構(AMED)難治性疾患実用化研究事業の診療に直結するエビデンス創出研究「HAM・HTLV-1陽性難治性疾患の患者レジストリを活用したエビデンス創出研究(JP24ek0109735)」およびAMED新興・再興感染症に対する革新的医薬品等開発推進研究事業「ゲノム情報を基盤としたHTLV-1 感染症の病態形成機序の解明及び発症リスク予知アルゴリズム開発に関する総合的研究(JP25fk0108672)」の支援を受けて実施されました。
研究者プロフィール
山野嘉久(ヤマノヨシヒサ)
聖マリアンナ医科大学 脳神経内科・難病治療研究センター病因病態解析部門 主任教授
研究領域:神経内科学、HTLV-1関連脊髄症(HAM)
関連研究室