慢性骨髄性白血病幹細胞のチロシンキナーゼ阻害薬抵抗性の分子基盤の一端を解明―慢性骨髄性白血病の根治療法の開発に期待―
- 記者発表
東京大学医科学研究所
東京大学大学院新領域創成科学研究科
発表のポイント
◆ 休止期(G0期)の慢性骨髄性白血病幹細胞を、G0マーカーを用いて同定し、チロシンキナーゼ阻害薬抵抗性(注1)の分子基盤の一端を明らかにしました。
◆ 慢性骨髄性白血病幹細胞の薬剤抵抗性獲得には、炎症シグナルの亢進(注2)とそれに続く免疫チェックポイント分子(注3)の発現の惹起(じゃっき)が重要であることを突き止めました。
◆ 炎症シグナル及び免疫チェックポイント分子の阻害薬とチロシンキナーゼ阻害薬との併用は、白血病幹細胞の駆逐に効果的であり、慢性骨髄性白血病の根治治療への応用が期待されます。
発表概要
慢性骨髄性白血病(Chronic Myeloid Leukemia: CML)は、造血幹細胞を原発とする骨髄増殖性疾患です。近年、イマチニブ(注4)を始めとするチロシンキナーゼ阻害剤(Tyrosine Kinase Inhibitor: TKI)がCMLに対して著明な効果をあげたことによって、CMLの予後は劇的に改善しました。しかしながらCMLが完全寛解しても、CML幹細胞が休止期(G0期)にありTKI抵抗性であることから残存し再発の原因となっていました。
今回、東京大学医科学研究所 細胞療法分野の北村俊雄教授、田中洋介助教と、東京大学大学院新領域創成科学研究科の合山進教授らのグループは、順天堂大学の小松則夫特任教授、高久智生准教授との共同研究でCML幹細胞のTKI抵抗性獲得の分子基盤の一端を明らかにし、それを標的とすることでCML幹細胞を効果的に駆逐できることを明らかにしました。
本研究では、まず細胞の休止期(G0期)を可視化できるG0マーカー(注5)を用いて、マウスCML様モデルにおいて、G0期のCML幹細胞を同定しました。続いて無治療群とイマチニブ治療群との遺伝子発現解析の比較から、G0期のCML幹細胞のイマチニブ抵抗性には、炎症シグナルの亢進とそれに続く免疫チェックポイント分子の発現の惹起(じゃっき)が重要であることを突き止めました。さらに、イマチニブと炎症シグナルあるいは免疫チェックポイント分子の阻害剤との併用は効果的にCML幹細胞を駆逐できることを明らかにしました。これらの結果は、炎症シグナルを標的としたCMLの根治療法の開発に役立つことが期待されます。本研究成果は2022年1月12日、英国科学誌「Nature Communications」(オンライン版)に発表されました。
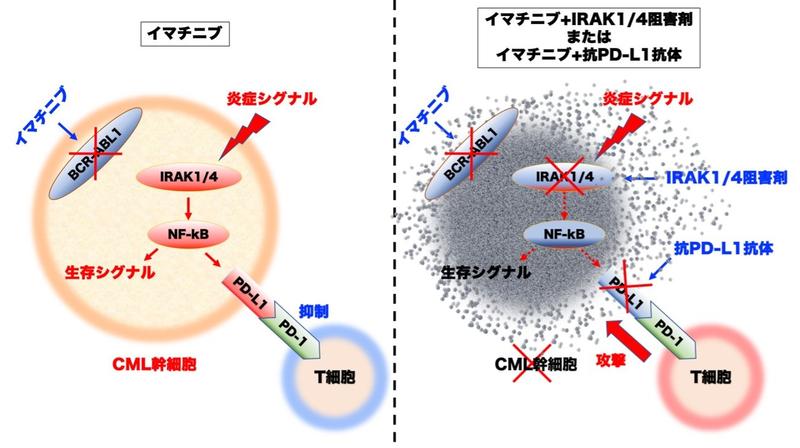
本研究の概要:イマチニブ耐性CML幹細胞は炎症シグナルによりBCR-ABL1非依存的に生存している
CML幹細胞はイマチニブ存在下ではBCR-ABL1非依存的に炎症シグナルによるNF-kBの活性化を通じて生存している。さらに、炎症シグナルの亢進はPD-L1の発現を惹起し、T細胞抗腫瘍免疫の回避も可能にしている。炎症シグナルのメディエーターであるIRAK1/4を阻害することでCML幹細胞の生存シグナルの遮断、あるいはPD-L1を抗PD-L1抗体によりブロックすることでT細胞による攻撃が可能になり、効果的にCML幹細胞を駆逐できる。
発表内容
CMLは造血幹細胞を原発とする骨髄増殖性疾患であり、9番と22番染色体の相互転座t(9:22)(q34:q11)によって形成されるPhiladelphia(Ph)染色体を特徴とします。Ph染色体上に生じたBCR-ABL1融合遺伝子がコードするBCR-ABL1チロシンキナーゼが恒常的に活性化することで、細胞増殖の亢進やアポトーシス抑制をもたらし、造血幹細胞の腫瘍化を引き起こします。近年、イマチニブを始めとする種々のTKIがCMLに対して著明な効果をあげたことによってCMLの予後は劇的に改善しました。しかしながらCMLが完全寛解しても、CML幹細胞が休止期(G0期)にありTKI抵抗性であることから残存し再発の原因となっていました。本研究はマウスCML様モデルにおいてG0期のCML幹細胞のTKI抵抗性の分子基盤を解析し、CML根治を目指した治療法を模索しました。
まず、G0期のCML幹細胞を特定するために、G0マーカーを導入したマウスCMLモデルを構築しました。具体的には、レトロウイルスベクター(注6)により血液細胞特異的にG0マーカーを発現しているG0マーカーマウス(Fukushima et al. Cell Rep.29, 4144-4158, 2019)の骨髄細胞にBCR-ABL1を導入し、致死量放射線照射したマウスに移植しました。約3週後にCMLを発症したマウス骨髄細胞のBCR-ABL1陽性造血幹前駆細胞分画をG0マーカーとCML幹前駆細胞マーカーのCD27とで分取し、致死量放射線照射したマウスに2次移植することでCML発症能を指標にしてCML幹細胞の特定を行ったところ、CML幹細胞はG0マーカー/CD27共陽性分画に多く含まれることが明らかになりました。この分画はイマチニブに対する抵抗性があったため、この分画をCML幹細胞として研究を進めました。
イマチニブ抵抗性の分子基盤を探るために、無治療群とイマチニブ治療群とから採取したCML幹細胞の遺伝子発現比較解析を行ったところ、イマチニブ治療群のCML幹細胞ではIRAK1/4-NF-kB経路(注7)が活性化し、その下流でPD-L1の発現が惹起されることがわかりました。そこでIRAK1/4阻害剤と抗PD-L1抗体の治療効果を調べたところ、それぞれ単独で若干の効果を示し、イマチニブとの併用では強い協調効果が認められました。中でもイマチニブと抗PD-L1抗体の併用療法は多くのCMLマウスにおいてCMLの治癒をもたらしました。また、無治療群、単独治療群と比べて、両併用群ではCML幹細胞の絶対数の激減、アポトーシスの亢進、さらにNF-kBの不活性化が確認できたことから、併用療法のCML幹細胞への有効性が確認できました。
次に、ヒトCML幹細胞に対するIRAK1/4阻害剤の効果を検証しました。培養系並びにゼノグラフトモデル(注8)において、IRAK1/4阻害剤とイマチニブとの併用はIRAK1/4阻害剤の濃度依存的に初診のCML検体より採取したヒトCML幹細胞に対して効果を認めました。これらの結果から、ヒトCML幹細胞に対してもIRAK1/4阻害剤とイマチニブとの併用療法の有効性が明らかになりました。
さらに本論文では、腎細胞癌治療中にCMLを発症した症例にダサチニブ(注9)とニボルマブ(注10)が投与された臨床例においてCMLが寛解に入る速度が早かったことを報告しました。これらの研究成果は、TKIと炎症シグナル阻害剤及びTKIと免疫チェックポイント阻害薬の併用がヒトCML幹細胞の駆逐に効果的である可能性を示唆するものであり、CMLの根治療法の開発へのヒントを与えるものであります。
発表雑誌
雑誌名:「Nature Communications」(1月12日付けオンライン版)
論文タイトル:Eliminating chronic myeloid leukemia stem cells by IRAK1/4 inhibitors
著者:Tanaka, Y.*, Takeda, R., Fukushima, T., Mikami, K., Tsuchiya, S., Tamura, M., Adachi, K., Umemoto, T., Asada, S., Watanabe, N., Morishita, S., Imai, M., Nagata, M., Araki, M., Takizawa, H., Fukuyama, T., Lamagna, C., Masuda, E., Ito, R., Goyama, S., Komatsu, N., Takaku, T., and Kitamura, T.*
DOI番号:10.1038/s41467-021-27928-8
URL:https://www.nature.com/articles/s41467-021-27928-8
発表者
北村 俊雄(東京大学医科学研究所 附属先端医療研究センター 細胞療法分野 / 附属幹細胞治療研究センター 幹細胞シグナル制御部門 教授)
合山 進(東京大学大学院新領域創成科学研究科 メディカル情報生命専攻 先進分子腫瘍学分野 教授)
田中 洋介(東京大学医科学研究所 附属先端医療研究センター 細胞療法分野 / 附属幹細胞治療研究センター 幹細胞シグナル制御部門 助教)
用語解説
(注1)チロシンキナーゼ阻害薬抵抗性
タンパク質のリン酸化されるアミノ酸残基はチロシン、セリン、スレオニンの3つであるが、チロシン残基を特異的にリン酸化する酵素をチロシンキナーゼと呼ぶ。 チロシンキナーゼは細胞の多様なシグナル伝達に関与する。CMLの原因となるBCR-ABL1は恒常活性型のチロシンキナーゼ であり、白血病細胞の増殖・生存を惹起する。BCR-ABL1の分子標的薬であるチロシンキナーゼ 阻害剤は、BCR-ABL1の活性をオフにすることで白血病細胞を駆逐できるが、白血病幹細胞はチロシンキナーゼ 阻害薬で駆逐できないことから、チロシンキナーゼ 阻害薬抵抗性であると考えられている。
(注2)炎症シグナルの亢進
生体にウイルスや細菌が感染すると、まず樹状細胞という免疫細胞がこれらの病原体を認識し、炎症反応という一連の免疫反応を起こすことにより、侵入した病原体を攻撃する。樹状細胞は細胞膜上のToll(トール)様受容体(TLR)というセンサーを使って病原体を認識し、TLRから細胞内へシグナルが伝わり、最終的に転写因子NF-κBが活性化する。NF-κBは炎症応答に必要な遺伝子の発現を引き起こす。このシグナル経路が活性化することを炎症シグナルの亢進と呼んでいる。
(注3)免疫チェックポイント分子
免疫恒常性を保つために自己に対する免疫応答や過剰な免疫反応を抑制する分子群。本来、T細胞の過剰な活性化を抑制するとともに、自己を攻撃しないために存在しているが、がん細胞が免疫系からの攻撃を回避し増殖するために利用することが知られている。
(注4)イマチニブ
「分子標的薬」と呼ばれる新しいタイプの抗がん薬。がん細胞の増殖を指令するシグナル伝達経路を分子レベルで遮断する。BCR-ABL1チロシンキナーゼ、KITチロシンキナーゼなどが標的蛋白として知られている。
(注5)G0マーカー
細胞周期のG0期に高発現するp27の細胞周期の進行に影響を与えない変異型と蛍光タンパク質であるmVenusとの融合タンパク質。細胞周期がG0期にある細胞と早期のG1期の細胞をmVenusの蛍光により識別可能である。
(注6)レトロウイルスベクター
RNAウイルスであるレトロウイルスはウイルスRNAから逆転写酵素によりDNA合成し、宿主ゲノムに組み込まれる。レトロウイルスベクターは、この性質を利用して動物細胞への遺伝子導入を目的としたベクター。導入した細胞から二次的なウイルス産生はおこらない仕組みになっており安全性が確保されている。
(注7)IRAK1/4-NF-kB経路
IL-1受容体やTLRからのシグナルによりNF-kBが活性化される経路。炎症反応や自然免疫反応のシグナルを主に伝達する。
(注8)ゼノグラフトモデル
異種移植、すなわち異なる種由来の組織を移植する際の移植片。がん研究では、ヒト由来のがん細胞を免疫不全マウスに移植し抗がん剤投与等の実験を行う。細胞株に比べてゼノグラフトはより生体内の環境を再現した実験系だと考えられている。
(注9)ダサチニブ
第二世代チロシンキナーゼ阻害薬であるダサチニブはBCR-ABL1をはじめとした複数のチロシンキナーゼを標的としており、慢性骨髄性白血病やフィラデルフィア染色体陽性の急性リンパ性白血病の治療に用いられている。
(注10)ニボルマブ
抗PD-1抗体薬。抗PD-1抗体は、T細胞上のPD-1に結合してPD-1とPD-L1/PD-L2の結合を阻害することにより、抑制シグナルの伝達をブロックしてT細胞の活性化を維持し、抗腫瘍効果を回復させます。新たな機序の抗がん治療薬として注目されている。