スプレーで植物を改変 - 簡便な非遺伝子組換え植物改変法の開発 -
- ヘッドライン
- 記者発表
理化学研究所
京都大学
宇都宮大学
東京大学
科学技術振興機構
発表概要
理化学研究所(理研)環境資源科学研究センターバイオ高分子研究チームのチョンパラカン・タグン特別研究員(研究当時、現京都大学大学院工学研究科特定助教)、小田原真樹研究員、児玉豊客員主管研究員(宇都宮大学バイオサイエンス教育研究センター教授)、沼田圭司チームリーダー(京都大学大学院工学研究科教授)、東京大学大学院新領域創成科学研究科の大谷美沙都准教授らの共同研究チームは、開発した担体と核酸をスプレーで噴霧することで、植物を簡便に改変する手法の開発に成功しました。
本研究成果は、非遺伝子組換え[1]により農作物を一過的に形質改変したものであり、耐病原性の付与や代謝産物の改変に貢献すると期待できます。
今回、共同研究チームは、「細胞透過性ペプチド(CPP)[2]」を基盤としたナノサイズの担体を用いてスプレーで噴霧することで、核酸を植物へ導入することに成功しました。この手法により、植物細胞内または葉緑体内で、導入した外来DNAから一過的にそのタンパク質を産生させ、また、siRNA[3]の導入により植物細胞内で目的タンパク質の発現を抑制することに成功しました。
本研究は、科学雑誌『ACS Nano』への掲載に先立ち、オンライン版(2月23日付:日本時間2月23日)に掲載されました。
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業総括実施型研究ERATO「沼田オルガネラ反応クラスタープロジェクト(研究総括:沼田圭司)」による支援を受けて行われました。
スプレーによる植物への核酸−細胞透過性ペプチド複合体の噴霧
発表内容
背景
植物の形質改変は、食糧問題や環境問題を解決し、社会にさまざまな豊かさをもたらします。しかし、植物ゲノムへの外来DNAの導入を基盤とした遺伝子組換え[1]による植物の改変は、工業規模では時間とコストがかかり、また人体や環境への安全性に懸念があります。
沼田圭司チームリーダーらはこれまで、機能性ペプチドを担体とした遺伝子導入による植物の改変法を開発してきました。機能性ペプチドによる改変は簡便かつ低コスト、また特定の細胞小器官[4]を標的とした改変が可能な手法ですが、小さな植物体や葉の一部など小さな規模での導入に限られていました注1-3)。
スプレーによる噴霧処理は、農場などの大きな規模でも対応可能な技術であることから、共同研究チームは今回、スプレー噴霧による機能性ペプチドを利用した植物への遺伝子導入法の開発を試みました。
注1)2018年7月20日プレスリリース「多様な植物に侵入するペプチドの探索」
https://www.riken.jp/press/2018/20180720_2/
注2)2019年1月22日プレスリリース「ペプチドによる遺伝子送達には植物の構造的脆弱性が重要」
https://www.riken.jp/press/2019/20190122_2/
注3)2019年10月23日プレスリリース「ペプチドによる色素体の改変」
https://www.riken.jp/press/2019/20191023_2/
研究手法と成果
共同研究チームは、まずスプレーによる核酸の導入に適した「細胞透過性ペプチド(CPP)」を選定しました。そして、選定したCPPと導入したいDNAの複合体を作製し、液体に懸濁した状態で植物の葉にスプレーで噴霧しました。その結果、モデル植物であるシロイヌナズナ、農作物であるトマト、ダイズの葉において、DNAが細胞内に効率的に取り込まれ、さらに取り込まれたDNAからレポーター遺伝子[5]GUS(β-グルクロニダーゼ)が発現していることを確認しました(図1A、B)。次に、CPPとsiRNAの複合体を形成し、蛍光タンパク質を発現している遺伝子組換えトマトやシロイヌナズナの葉に噴霧したところ、RNA干渉[6]によって蛍光タンパク質(GFPやYFP)の発現を抑制することに成功しました(図1C)。
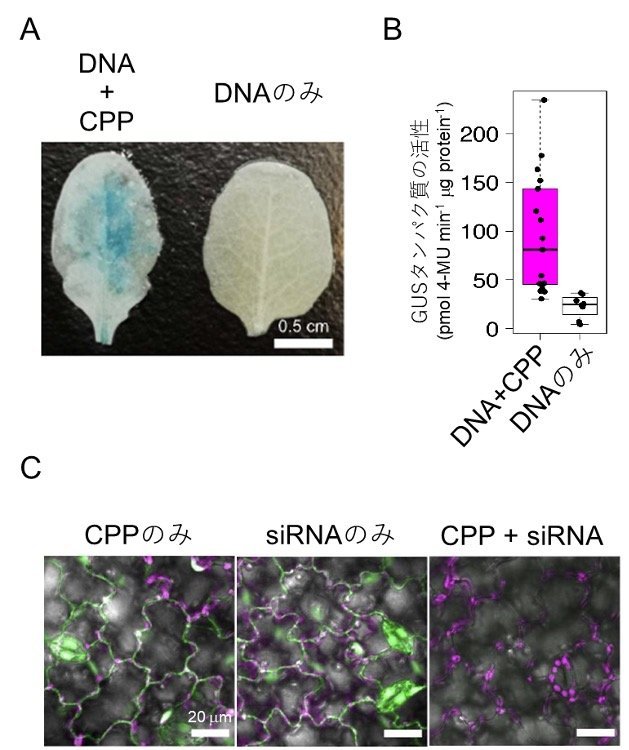
図1 スプレー処理した葉におけるDNAとRNAの取り込み
A:細胞透過性ペプチド(CPP)とDNAを導入したシロイヌナズナ葉におけるGUSタンパク質の検出。DNAとCPPを噴霧した左の葉では、レポーター遺伝子によって発現したGUSタンパク質の活性により青い物質が産生された。DNAだけを噴霧した右の葉では、GUSタンパク質は産生されなかった。
B:シロイヌナズナの葉におけるGUSタンパク質の活性。
C:siRNAを導入したトマト葉の緑色蛍光タンパク質(GFP)の発現抑制。左はGFPを発現した葉にCPPだけを噴霧した場合、中はsiRNAだけを噴霧した場合。右はCPPとsiRNAを噴霧した場合で、siRNA導入によりRNA干渉が起こり、GFPが減少した。マゼンタは葉緑体の自家蛍光。
共同研究チームはさらに、異なるペプチドを用いることでこの手法を発展させ、核酸を細胞小器官の葉緑体に送達することに成功しました。葉緑体特異的に送達されるペプチドのKH-AtOEP34とCPP、DNAからなる複合体を作製し、シロイヌナズナの葉にスプレーで噴霧したところ、葉緑体において導入したレポーター遺伝子(ルシフェラーゼ)の発現を確認しました(図2A)。また、同様の手法でsiRNAを葉緑体に送達した結果、遺伝子組換えによって葉緑体内で発現させていた蛍光タンパク質の発現を抑制することにも成功しました(図2B)。
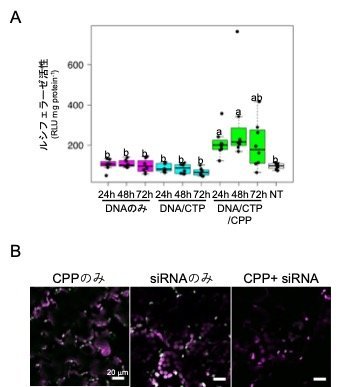
図2 スプレー処理したシロイヌナズナ葉の葉緑体におけるDNAとRNAの取り込み
A:ルシフェラーゼ遺伝子(レポーター遺伝子)を導入した葉の葉緑体におけるルシフェラーゼ活性。横軸は導入後の時間、縦軸は発光量を示す。CPPとKH-AtOEP34(葉緑体ターゲッティングペプチド)を組み合わせることで、葉緑体へのルシフェラーゼ遺伝子DNAの取り込みが促進された。
B:siRNA導入によるGFP発現抑制。緑色蛍光タンパク質(GFP)を葉緑体内で発現する植物体にペプチド(CPPとKH-AtOEP34)とsiRNAを導入することで、RNA干渉が起こり、GFPが減少した。マゼンタは葉緑体の自家蛍光。
これらの結果から、スプレーで噴霧したDNAやRNAはCPPの作用によって広範な植物細胞内、さらには細胞小器官内に送達され、非遺伝子組換えかつ一過的に外来遺伝子発現や遺伝子発現の抑制が可能であることが明らかになりました。
今後の期待
本研究では、最適化したCPPを用いた担体をスプレーで噴霧することによって、モデル植物のシロイヌナズナだけでなく、ダイズやトマトなどの農作物の葉に核酸を送達することに成功しました。特別な機器を必要とせず、効率的かつ一過的に植物への核酸導入が可能なこの手法は、農場規模の栽培スケールにおける一過的な農薬耐性の付与など、非遺伝子組換え的な農作物の改変に貢献することが期待できます。一方で、目的の植物以外の生物への意図せぬ核酸の導入といったリスクに関しては、今後慎重に評価する必要があります。
また本研究では、RNA干渉が起こらないとされている葉緑体において、siRNAの導入による遺伝子発現の抑制を観察しました。これは、これまでの常識を覆す結果であり、今後詳しく発現抑制機構を解析する必要があります。
今回の研究は、国際連合が2016年に定めた17項目の「持続可能な開発目標(SDGs)[7]」のうち「2. 飢餓をゼロに」や「15. 陸の豊かさも守ろう」などへの貢献が期待できます。
論文情報
タイトル:Non-transgenic gene modulation via spray delivery of nucleic acid/peptide complexes into plant nuclei and chloroplasts
著者名:Chonprakun Thagun, Yoko Horii, Maai Mori, Seiya Fujita, Misato Ohtani, Kousuke Tsuchiya, Yutaka Kodama, Masaki Odahara, Keiji Numata
雑誌:ACS Nano
用語解説
[1] 非遺伝子組換え、遺伝子組換え
本研究では、外来遺伝子を核や細胞小器官のDNAに組み込んで発現させる場合を遺伝子組換え、外来遺伝子を組み込まずに形質改変を行う場合を非遺伝子組換えと定義する。
[2] 細胞透過性ペプチド(CPP)
細胞膜を透過して細胞内へ移行できるペプチドの総称。CPPはCell-Penetrating Peptideの略。
[3] siRNA
21~25塩基対の二本鎖RNA。合成したsiRNAを細胞に取り込ませることにより、相補的な配列を持つ遺伝子の発現を抑制できる。siRNAはsmall interfering RNAの略。
[4] 細胞小器官
真核細胞内で特化した機能や形態を持つ、膜で区切られた器官の総称。核や小胞体、ゴルジ体が含まれる。
[5] レポーター遺伝子
解析したい遺伝子の発現を簡便に検出、定量するために導入される遺伝子。緑色蛍光タンパク質(GFP)はそれ自体の蛍光、βグルクロニダーゼ(GUS)は分解された基質の発色、ルシフェラーゼは分解された基質の発光により、遺伝子発現量を定量する。
[6] RNA干渉
細胞内に導入したRNAと相補的な配列を持つメッセンジャーRNA(mRNA)が分解され、遺伝子発現が抑制される現象。
[7] 持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴール、169のターゲットから構成され、発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる(外務省ホームページから一部改変して転載)。