脳腫瘍の悪性化を防ぐ最適な治療法を解明!ー 数学的アプローチにより明らかとなった症例毎に異なる最適治療戦略 ー
- ニュース
- 記者発表
名古屋大学
東京大学
発表のポイント
◆多くの低悪性度IDH変異神経膠腫患者さんの腫瘍体積、治療に関わる情報を数学的アプローチにより解析することで、これまで曖昧であった化学療法や放射線治療が腫瘍細胞の増殖及び悪性化に与える影響をより正確に同定することができました。
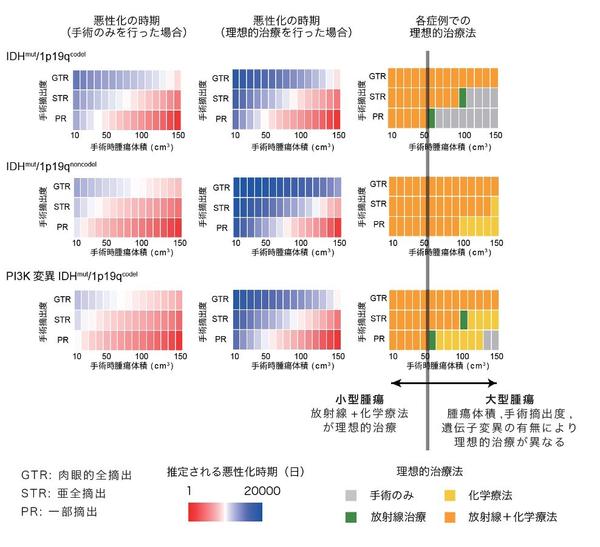
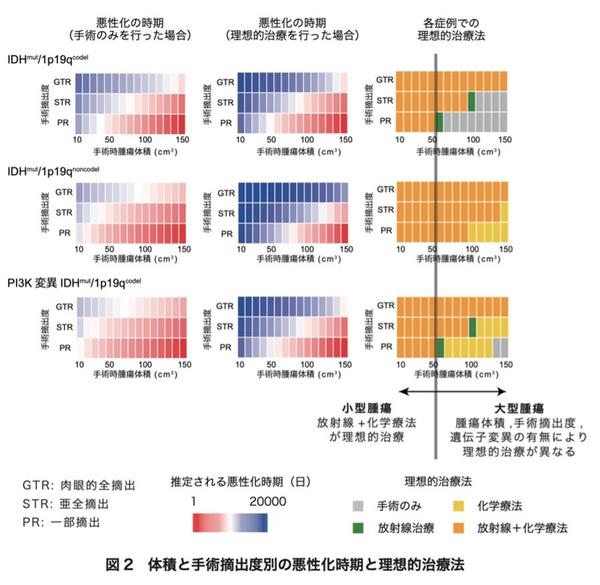
◆悪性化を防ぐ理想的な治療法は、低悪性度IDH変異神経膠腫の患者さん毎に異なることを示すことができました。小型の腫瘍(初回手術時体積が50cm3以下)では、手術後速やかに化学療法と放射線療法を開始することが、悪性化を防ぐ最適な治療法でありました。一方、大型の腫瘍(手術時体積が50cm3以上)では、手術において十分な手術摘出を行うことができず、特定の遺伝子変異パターンを示す場合には、術後治療がむしろ悪性化を早めてしまうことがわかりました。
◆数理モデルを用いて様々なシミュレーションを行った結果、早期診断早期治療が本腫瘍の悪性化を防ぐ上で極めて重要であることを初めて示すことができました。
発表概要
国立大学法人東海国立大学機構 名古屋大学大学院医学系研究科・脳神経外科学の青木恒介(あおきこうすけ)特任助教、夏目敦至(なつめあつし)准教授、東京大学大学院新領域創成科学研究科メディカル情報生命専攻の波江野洋(はえのひろし)特任准教授らは、数学的解析を用いて、低悪性度IDH変異神経膠腫※1の悪性化を抑えるのに最適な治療法を明らかにしました。
びまん性神経膠腫※2は、最も多い脳腫瘍の一つで難治性の腫瘍です。その中で、低悪性度IDH変異神経膠腫は30?40代に好発し、当初は緩徐に大きくなりますが経過中に悪性化し生命を脅かします。手術と共に、化学療法や放射線治療が腫瘍の増大を抑える一方で、これらの治療法は遺伝子変異を引き起こすことで悪性化を引き起こしてしまう可能性も報告されております。それぞれの患者さんに対して、どの治療をどのタイミングで行うのが悪性化を防ぐために最適な治療であるかはわかっておりません。
本研究では、日本の10施設にて治療を受けた276名の低悪性度IDH変異神経膠腫患者さんの経過中の全てのMRIデータと治療歴を用いて、腫瘍進行に関する数理モデル※3を構築し、同時に網羅的な遺伝子変異解析を行いました。これらの解析により、腫瘍細胞の遺伝子変異の数は悪性化のリスクと強く関連していること、化学療法や放射線療法などの術後治療は腫瘍の成長を抑制するものの、細胞あたりの悪性化のリスクを増加させることがわかりました。さらに、症例毎に悪性化を防ぐ理想的な治療法が異なることを初めて示すことができました。小型の腫瘍(初回手術時体積が50cm3以下)では、手術後速やかに化学療法と放射線療法を開始することが、悪性化を防ぐ最適な治療法であることを見出しました。一方、大型の腫瘍(手術時体積が50cm3以上)では、多くの症例では小型の腫瘍と同様に手術後速やかに化学療法と放射線を開始することが最適な治療法である一方で、手術摘出が不十分、特定の遺伝子変異パターンを示す場合には、術後治療がむしろ悪性化を早めてしまうことがわかりました。さらに、早期診断早期治療がこの腫瘍の悪性化を防ぐ上で極めて重要であることを示すことができました。本研究成果は、低悪性度IDH変異神経膠腫の悪性化を防ぎ、結果として生存率を向上させるために、"それぞれの患者さんにとって"最適な治療戦略を明らかにした、とても重要な知見と考えます。
本研究成果は、2021年7月31日付け米国癌学会誌「Cancer Research」のオンライン版に公開されました。
なお、本研究は、日本学術振興会の科学研究費助成事業「若手研究」、「基盤研究B」、「新学術領域研究」、日本脳神経財団、がん研究開発費、株式会社SRL及びH.U.グループによる社会連携講座共同研究費の支援を受けて実施されました。
発表内容
1.背景
びまん性神経膠腫は、中枢神経系悪性腫瘍の約80%を占め、世界保健機関(WHO)により、その病理組織学的および臨床的挙動に応じて、グレードII~IVに分類されています。WHO悪性度IIのびまん性神経膠腫の約80%がIDH(IDH1もしくはIDH2)遺伝子変異を持ち、通常、低悪性度IDH変異神経膠腫と呼ばれます。この腫瘍は、一般的に緩徐な増殖を示しますが、しばしば悪性化を起こし、高悪性度の腫瘍として再発し生命を脅かします。歴史的には、低悪性度IDH変異神経膠腫に対して、症状が出現するまで治療を行わないいわゆる「様子見(wait-and-see)」治療が好まれることが多かったのですが、その後早い段階での手術の有効性が示されたこと、また水が染み込むように周りに広がる性質(びまん性浸潤)を持つことから、手術単独での治癒は期待できないことにより、現在では手術と共に化学療法や放射線治療が広く行われています。化学療法や放射線治療は腫瘍の増大を抑える一方で、遺伝子変異を引き起こすことで悪性化を誘発する可能性も報告されております。それぞれの患者さんに対して、どの治療をどのタイミングで行うのが悪性化を防ぐために最適な治療であるかはわかっておりません。
これまで様々な悪性腫瘍の実験データや臨床データを解釈するために、数学的なアプローチ(数理モデル)が適用されてきました。この手法を用いることで、限られたデータからデータの裏にある機序を推定したり、例えば「既に有効であるとされている治療を行わない患者群を設ける」など倫理的に行うことができない比較を、コンピューター上でシュミレーションしたりすることが可能となります。今回は、日本の10施設で治療された276例の低悪性度IDH変異神経膠腫のMRIから算出した腫瘍体積と治療歴を含む時系列データを用いて、治療による影響を加味した腫瘍増殖に関する数理モデルを構築し、さらに網羅的な遺伝子変異解析を行うことで、各治療が腫瘍の増殖および悪性化に与える影響を推定し、各症例おいて悪性化を防ぐ最適な治療戦略を明らかにすることを目指しました。
2.研究成果
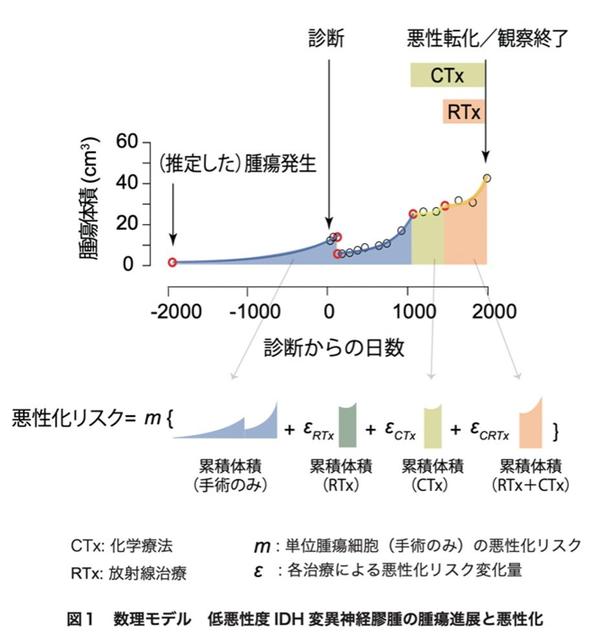
現在では、低悪性度IDH変異神経膠腫は1番染色体の短腕(1p)と19番染色体の長腕(19q)が共に欠失(1p/19q共欠失※4)している症例(IDHmut/1p19codel)と、していない症例(IDHmut/1p19noncodel)で、臨床経過などが大きく異なることから、これらを別サブタイプとして分類する分類が、WHOを含め広く用いられており、本研究においても同分類を採用し解析を行いました。各患者さんの経過中の腫瘍体積変化から治療毎の腫瘍増殖速度を推定したところ、手術単独に比べ化学療法や放射線治療を行うと明らかに腫瘍増殖速度が緩徐になっていました。続いて数学的アプローチを用いて細胞あたりの悪性転化リスクを推定しました。具体的には1)腫瘍細胞が遺伝子変異などの「悪性化に関わるイベント」を稀に獲得し、これが一定数蓄積された段階でその細胞は悪性化すると仮定し、2)化学療法や放射線治療は、これらの治療を受けていない腫瘍細胞に比べ「悪性化に関わるイベント」を獲得する確率を変化させると仮定して、各症例の経過中の悪性化リスクを計算しました(図1)。実際に悪性転化した人と悪性化しなかった人を比較し、最も当てはまりがいい値を採用しました。その結果、化学療法や放射線治療を行うことで細胞あたりの悪性転化リスクが、手術のみを行った細胞に比べて1.8?2.8倍になることがわかりました。続いて算出した各値を用いて、様々な症例において治療法および治療開始時期を様々に変化させて悪性転化時期がどう変化するのかをシミュレーションを行いました。その結果、悪性化を防ぐ理想的な治療法が異なることがわかりました。小型の腫瘍(初回手術時体積が50cm3以下)では、手術後速やかに化学療法と放射線療法を開始することが、悪性化を防ぐ最適な治療法でありました。一方、大型の腫瘍(手術時体積が50cm3以上)では、染色体1p/19q共欠失を持たない腫瘍では手術後速やかに化学療法と放射線を開始することが最適な治療法でしたが、1p/19q共欠失を持つ腫瘍では、十分な手術摘出を行うことが困難、またIDHmut/1p19codel においてPI3K(PIK3CAもしくはPIK3R1)変異※5を持たない場合には、術後治療がむしろ悪性化を早めてしまうことがわかりました(図2)。同時に、もしも実際の診断時より腫瘍が小さな段階で診断し治療を行うことができた場合に悪性化の時期がどう変化するのかをシミュレーションしたところ、腫瘍が可能な限り小さい段階で手術し、化学療法および放射線を行うことが、悪性化を防ぐのに極めて重要であることがわかりました。つまり、低悪性度IDH変異神経膠腫の悪性を防ぐ上で、早期診断早期治療が極めて重要であることを示すことができました。
3.今後の展開
本研究成果をもとに、低悪性度IDH変異神経膠腫の各患者さんにとって、悪性化を防ぎ、結果として生存率を向上させる治療が行っていける可能性が高いと考えております。また、本解析アプローチは、新たな治療法や他の悪性腫瘍にも応用可能な汎用性の高いものであると考えております。
用語説明
※1 低悪性度IDH変異神経膠腫:後述するびまん性神経膠腫(※2)の中でグレードIIのものを通常、低悪性度神経膠腫と呼びます。低悪性度神経膠腫の80%はIDH遺伝子変異を認め、特徴的な遺伝的/臨床的な特徴を持つことが知られています。これらを低悪性度IDH変異神経膠腫と呼びます。
※2 びまん性神経膠腫:脳から発生する脳腫瘍の中で最も多く認められるもので、水が染み込むように周りに広がる性質が特徴です。その病理組織学的および臨床的挙動に応じて、グレードII~IVに分類されています。
※3 数理モデル:自然や社会のありようなど現実の対象を簡略化し、諸量の関係を数式で記述した系のことを言います。近年はコンピューターの性能の著しい向上にともない、より複雑な現象を数理モデルに基づいてシミュレーションすることが可能になっています。
※4 染色体1p/19q共欠失:通常、核内に染色体はそれぞれ二本ずつ存在します。しかし低悪性度IDH変異神経膠腫のおよそ半数は、1番染色体の短腕(1p)と19番染色体の長腕(19q)(1p/19q)が共に欠失(共に一本しかない)しています。1p/19qが共に欠失している症例と欠失していない症例で、生命予後を含め性格が大きく異なることから、現在では別のサブタイプとして扱われています。
※5 PI3K:phosphatidylinositol-3 kinase 膜の構成成分であるイノシトールリン脂質のイノシトール環3位のリン酸化を媒介する脂質キナーゼです。
発表雑誌
掲雑誌名:Cancer Research
論文タイトル:Mathematical modeling and mutational analysis reveal optimal therapy to prevent malignant transformation in grade II IDH-mutant gliomas
著者:Kosuke Aoki1,2,*, Hiromichi Suzuki1, Takashi Yamamoto1, Kimiyo N Yamamoto3, Sachi Maeda1, Yusuke Okuno4, Melissa Ranjit1, Kazuya Motomura1, Fumiharu Ohka1, Kuniaki Tanahashi1, Masaki Hirano1, Tomohide Nishikawa1, Hiroyuki Shimizu1, Yotaro Kitano1, Junya Yamaguchi1, Shintaro Yamazaki1, Hideo Nakamura5,6, Masamichi Takahashi7, Yoshitaka Narita7, Mitsutoshi Nakada8, Shoichi Deguchi9, Masahiro Mizoguchi10, Yasutomo Momii11, Yoshihiro Muragaki12, Tatsuya Abe13, Jiro Akimoto14, Toshihiko Wakabayashi1, Ryuta Saito1, Seishi Ogawa15, Hiroshi Haeno16,*, and Atsushi Natsume1,2,*
所属:1Department of Neurosurgery, Graduate School of Medicine, Nagoya University; showa-ku, Nagoya, Aichi 466-8550, Japan.
2Institute of Nano-Life-Systems, Institutes of Innovation for Future Society, Nagoya University; Chikusa-ku, Nagoya, Aichi 464-8603, Japan.
3Departments of General and Gastroenterological Surgery, Osaka Medical College Hospital; Takatsuki-shi, Osaka 569-8686, Japan
4Medical Genomics Center, Nagoya University Hospital; showa-ku, Nagoya, Aichi 466-8550, Japan.
5Department of Neurosurgery, Kumamoto University; Chuo-ku, Kumamoto 860-8556, Japan.
6Department of Neurosurgery, Kurume University; Kurume, Fukuoka 830-0011, Japan.
7Department of Neurosurgery and Neuro-oncology, National Cancer Center Hospital; Chuo City, Tokyo 104-0045, Japan.
8Department of Neurosurgery, Kanazawa University; Kanazawa, Ishikawa 920-8641, Japan.
9Division of Neurosurgery, Shizuoka Cancer Center Hospital; Sunto District, Shizuoka 411-8777, Japan.
10Department of Neurosurgery, Graduate School of Medical Sciences Kyushu University; Higashi-ku, Fukuoka 812-8582 Japan.
11Department of Neurosurgery, Oita University; Yufu, Oita 879-5593, Japan.
12Department of Neurosurgery, Tokyo Women's Medical University; Shinjuku City, Tokyo, 162-0054 Tokyo, Japan.
13Department of Neurosurgery, Faculty of Medicine, Saga University; Nabeshima, Saga 849-0937, Japan.
14Department of Neurosurgery, Tokyo Medical University; Shinjuku City, Tokyo 160-0023, Japan.
15Department of Pathology and Tumor Biology, Graduate School of Medicine, Kyoto University; Sakyo-ku, Kyoto 606-8501, Japan.
16Department of Computational Biology and Medical Sciences, Graduate School of Frontier Sciences, The University of Tokyo; Kashiwa-shi, Chiba 277-8561, Japan.
DOI:10.1158/0008-5472.CAN-21-0985