がんに存在する異常なメッセンジャーRNAの全長構造を同定 ―がん免疫療法のための新たな診断基準になる可能性―
- ニュース
- 記者発表
発表のポイント
◆長い配列を読み取れるナノポアシークエンサーで、肺がんに存在する異常なメッセンジャーRNA(mRNA)の網羅的な同定を行いました。
◆がんに存在する異常なmRNAから生じるペプチドが免疫細胞に認識される可能性を示しました。
◆異常なmRNAの蓄積が、がん免疫療法が効くかどうかを予測するための新しい指標となる可能性があります。
発表概要
東京大学大学院新領域創成科学研究科の関 真秀特任助教と鈴木 穣教授らのグループは、国立がん研究センター先端医療開発センター免疫療法開発分野・中面哲也分野長らとの共同研究により、ナノポアシークエンサー(注1)で肺がんに存在する異常なmRNAの網羅的な同定をして、異常なmRNAから生じるペプチドが免疫細胞に認識されることを示しました。
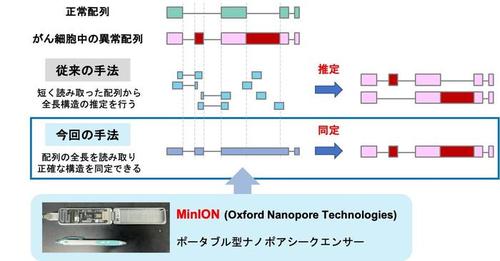
従来よく用いられているシークエンサーは、RNAをばらばらに短くしてから配列を読み取っていたため、mRNAの全長配列を読み取ることはできませんでした。それに対して、長い配列を読み取れるナノポアシークエンサーは、mRNAの全長配列を読み取ることができます。
今回、肺がんにナノポアシークエンサーを用いて、正常な組織に存在しない異常なmRNAの全長構造をカタログ化しました。さらに、異常なmRNAから生じるペプチド配列が免疫細胞によって認識されることを示しました。異常mRNAの蓄積が、がん免疫療法が効くかどうかの新たな指標となる可能性があります。
本研究成果は、2021年1月4日(月)に英国科学雑誌「Genome Biology」のオンライン版で掲載されました。
発表内容
研究の背景・先行研究における問題点
mRNAは、DNAから転写されたあと余分な部分を除くスプラインシングと呼ばれる機構によって成熟型へと加工されます。がん細胞では、スプライシング機構や、NMD(注2)と呼ばれる不要なRNAを分解する品質管理機構が壊れることなどにより、異常なmRNAが蓄積することが知られていました。しかし、現在よく用いられているシークエンサーは、RNAをばらばらに短くしてから100塩基程度の長さの配列を読み取っていたため、mRNAの全長構造を読み取ることはできず、どのような全長構造を持ったmRNAが存在しているのかは、十分にわかっていませんでした。
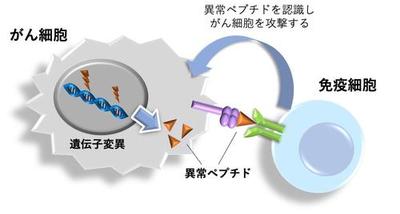
がん細胞は突然変異によって、正常細胞にない異常なタンパク質を発現するようになります。タンパク質は切断されることで、ペプチドと呼ばれるタンパク質の断片ができます。免疫細胞は、がん細胞にしかないペプチド(ネオアンチゲン)を認識することでがん細胞を見分けて攻撃します(図1)。数年前にノーベル賞で話題となったがん免疫療法に使用される免疫チェックポイント阻害薬は、がん細胞が免疫を抑制することを阻害する薬ですが、効く人と効かない人に分かれることがわかっています。1塩基の突然変異の量(腫瘍遺伝子変異量; TMB)が、ネオアンチゲンの量に比例するため、効くかどうかを予測するための指標として知られていました。しかし、TMBだけでは予測がつかない症例もあることから、それ以外にも新しい指標が必要とされています。
研究内容
今回、22種類の肺がんの培養細胞株と7症例の肺がん検体について、ナノポアシークエンサーでDNAに変換したmRNAの全長を読み取ること(全長cDNAシークエンス)で、がんに存在する異常mRNAの全長構造のカタログ化を行いました(図2)。
次に、異常mRNAが蓄積する理由を探るために、最も異常mRNAの多かった細胞株で突然変異が見られたUPF1遺伝子とがんで高い頻度に突然変異が見られる遺伝子であるSF3B1遺伝子の発現量を低下させて、異常mRNAの蓄積への影響を調べました。UPF1はmRNAの品質管理機構の一つのNMDに関わる遺伝子、SF3B1はmRNAのスプライシングに関わる遺伝子として知られています。全長cDNAシークエンスを行った結果、いずれの遺伝子の発現の低下によっても異常mRNAが蓄積することを示しました。
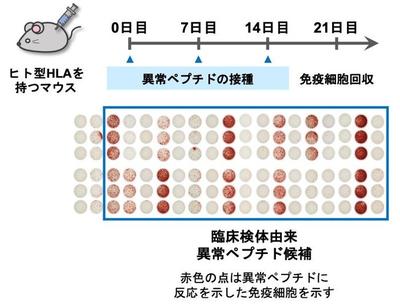
異常mRNAからペプチドができているのかを確認するために、プロテオーム解析を行った結果、いくつかのペプチドについてその存在が確認できました。さらに、異常なmRNAに由来する異常なペプチド配列が免疫細胞に認識されやすいかの予測を行いました。その結果、異常なmRNA由来のペプチド配列は、1塩基の突然変異由来のものよりも予測されたスコアが高いものが多いことが示されました。ペプチドを免疫細胞に提示する役割を持つHLA遺伝子をヒト型にしたマウスに、17種類のペプチドを注射して、ペプチドに反応する免疫細胞ができたのかをELISpotアッセイで調べました(図3)。その結果、半数程度のペプチドについて、反応する免疫細胞ができたことを確認できました。
作成した異常mRNAのカタログを利用して、米国のがんゲノムプロジェクトTCGAのデータを調べたところ、NMDの遺伝子に突然変異を持つ肺腺がんの検体で異常mRNAの多い傾向が見られました。
社会的意義・今後の予定など
今回、がんの異常mRNAの検出のために、全長cDNAシークエンスが有効であることと、異常mRNAから多数のネオアンチゲンが生じている可能性を示しました。異常mRNAの量や異常mRNAに影響を与える遺伝子の突然変異は、がん免疫療法が効くかどうかの新たな指標となる可能性があります。
本研究は、文部科学省科学研究費助成事業 新学術領域研究(16H06279及び17H06306)、日本学術振興会科学研究費助成事業 若手研究(19K16108及び19K16792)、国立がん研究センター研究開発費(29-A-02及び29-A-06)の支援を受けて行われました。本研究でカタログ化した異常mRNAの全長構造は、科学技術振興機構(JST)バイオサイエンスデータベースセンター(NBDC)統合推進化プログラムにより支援されているデータベースDBKERO(https://kero.hgc.jp/)より公開予定です。
発表雑誌
雑誌名:「Genome Biology」(オンライン版:1月4日)
論文タイトル:Aberrant splicing isoforms detected by full-length transcriptome sequencing as transcripts of potential neoantigens in non-small cell lung cancer
著者:Miho Oka, Liu Xu, Toshihiro Suzuki, Toshiaki Yoshikawa, Hiromi Sakamoto, Hayato Uemura, Akiyasu C. Yoshizawa, Yutaka Suzuki, Tetsuya Nakatsura, Yasushi Ishihama, Ayako Suzuki, Masahide Seki
DOI番号:10.1186/s13059-020-02240-8
アブストラクトURL:https://doi.org/10.1186/s13059-020-02240-8
発表者
岡 実穂(東京大学大学院新領域創成科学研究科 メディカル情報生命専攻 博士後期課程3年生)
許 柳 (研究当時:東京大学大学院新領域創成科学研究科 メディカル情報生命専攻 修士課程2年生)
坂本裕美(国立研究開発法人国立がん研究センター研究所 基盤的臨床開発研究コアセンターユニット長)
中面哲也(国立研究開発法人国立がん研究センター先端医療開発センター 免疫療法開発分野長)
鈴木 穣(東京大学大学院新領域創成科学研究科 メディカル情報生命専攻 教授)
鈴木絢子(東京大学大学院新領域創成科学研究科 メディカル情報生命専攻 特任准教授)
関 真秀(東京大学大学院新領域創成科学研究科 メディカル情報生命専攻 特任助教)
用語解説
(注1)ナノポアシークエンサー:ナノポアと呼ばれる数ナノメートルの穴をDNAやRNAが通るときの電流の変化を読み取ることで、DNAやRNAの配列を読み取ることのできる機械です。
(注2)NMD:ナンセンスコドン介在的mRNA分解。NMD(nonsense mediated mRNA decay)。異常なタンパク質の合成を防ぐ機構のひとつ。mRNAからタンパク質を合成する際の終わりの目印であるナンセンスコドンが本来あるべき場所よりも前にある場合にmRNAを分解する機構です。
添付資料
図1.がん細胞を免疫細胞が認識するメカニズム
図2.ナノポアシークエンサーMinIONを使用した異常mRNAの検出について
図3.ELISpotアッセイによる異常ペプチドの評価
関連研究室
お問い合わせ