大腸がん・乳がん・前立腺がんの遺伝学的検査の有効性を検証
- ニュース
- 記者発表
理化学研究所
東京大学大学院新領域創成科学研究科
日本医療研究開発機構
理化学研究所(理研)生命医科学研究センター基盤技術開発研究チームの劉 暁渓 基礎科学特別研究員(研究当時)、桃沢幸秀チームリーダー、東京大学大学院新領域創成科学研究科の松田浩一教授らの共同研究グループ※は、日本人の大腸がん・乳がん・前立腺がん患者らの全ゲノムシークエンス解析[1]を行い、各がんの遺伝学的検査に対する有効性を検証しました。
本研究成果は、大腸がん・乳がん・前立腺がんにおけるオーダーメイド医療[2]の実現に貢献すると期待できます。
がん患者の5~10%は、遺伝子上に存在する「病的バリアント[3]」が原因で発症すると考えられており、発見される遺伝子の傾向は人種間で異なります。世界最大規模のNCCNガイドライン[4]は主に欧米人集団のデータをもとに作成されているため、日本人集団ではどの程度有効か明確ではありませんでした。
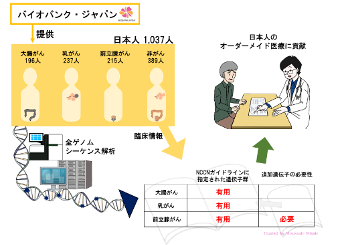
今回、共同研究グループが、バイオバンク・ジャパン[5]で収集された大腸がん・乳がん・前立腺がんの早期発症者を含む日本人1,037人の全ゲノムシークエンス解析を行った結果、NCCNガイドラインで各疾患の遺伝学的検査の対象に指定されている遺伝子(大腸がん:12個、乳がん:11個、前立腺がん:9個)に病的バリアントを保有する日本人患者の割合は、乳がん、大腸がん、前立腺がんの順に高いことが分かりました。さらに、NCCNガイドラインに指定されていない遺伝子も調べるため、CGCデータベース[6]に含まれる98遺伝子を解析したところ、前立腺がんの患者に病的バリアントが多く検出されました。これらの結果により、NCCNガイドラインに指定された遺伝子は日本人集団に対する検査でも有用であること、一方で前立腺がんではその他の遺伝子も検査する必要があることが明らかになりました。
本研究は、科学雑誌『JCO Precision Oncology』のオンライン版(3月24日付)に掲載されました。
▲オーダーメイド医療の実現に貢献
※共同研究グループ
理化学研究所
生命医科学研究センター
基盤技術開発研究チーム
基礎科学特別研究員(研究当時) 劉 暁渓(リュウ・ギョウケイ)
(現 ゲノム解析応用研究チーム 研究員)
チームリーダー 桃沢 幸秀(ももざわ ゆきひで)
テクニカルスタッフ 高田 定暁(たかた さだあき)
テクニカルスタッフ(研究当時) 芦川 享大(あしかわ きょうた)
テクニカルスタッフ 碧井 智美(あおい ともみ)
ゲノム免疫生物学理研白眉研究チーム
チームリーダー ニコラス・F・パリッシュ(Nicholas F. Parrish)
統計解析研究チーム
チームリーダー(研究当時) 鎌谷 洋一郎(かまたに よういちろう)
(現 ゲノム解析応用研究チーム 客員主管研究員、
東京大学大学院新領域創成科学研究科 メディカル情報生命専攻 複雑形質解析分野 教授)
上級研究員(研究当時) 寺尾 知可史(てらお ちかし)
(現 ゲノム解析応用研究チーム チームリーダー)
研究員(研究当時) 小杉 俊一(こすぎ しゅんいち)
(現 ゲノム解析応用研究チーム 研究員)
がんゲノム研究チーム
チームリーダー 中川 英刀(なかがわ ひでわき)
統合生命医科学研究センター(研究当時)
副センター長(研究当時) 久保 充明(くぼ みちあき)
東京大学大学院新領域創成科学研究科 メディカル情報生命専攻 クリニカルシークエンス分野
教授 松田 浩一(まつだ こういち)
研究支援
本研究は、日本医療研究開発機構(AMED)のオーダーメイド医療の実現プログラム「疾患関連遺伝子等の探索を効率化するための遺伝子多型情報の高度化(研究開発代表者:久保 充明)」の支援のもと行われました。
研究の背景
がんは日本人の死因として最も多く、2018年には28.4%の人ががんで死亡しています注1)。がんの発症には、飲酒や肥満、身体活動度などの生活習慣要因だけではなく、両親から受け継がれる遺伝的要因も寄与します。個人間におけるゲノム配列[7]の違いである「遺伝子バリアント」のうち、疾患の発症と大きく関わるものを「病的バリアント」といいます。病的バリアントが原因で発症するがん患者は、全体の5~10%を占めると考えられています。
病的バリアントは、遺伝学的検査によって明らかにできます。例えば、BRCA1やBRCA2のような特定の遺伝子に病的バリアントを保有していると、乳がんや卵巣がんのリスクが高くなりますが、PARP阻害剤[8]などの薬が効果的であることが知られています注2)。また、病的バリアントの有無は患者の近親者にとっても重要であり、遺伝学的検査を行うことで発症リスクを評価し、早期発見のための検診や健康管理を行うことができます。
しかし、病的バリアントが発見される遺伝子の傾向は人種間で異なり、世界最大規模である米国のNCCNガイドラインは主に欧米人のデータをもとに作成されているため、日本人にとってはどの程度有効か明確ではありませんでした。そこで、共同研究グループは、大腸がん、乳がん、前立腺がんの早期発症患者を含む日本人集団を対象に、全ゲノムシーケンス解析を行い、NCCNガイドラインに指定されている遺伝子が日本人集団にも重要であるか評価を試みました。
注1)厚生労働省 死亡数・死亡率(人口10万対),死因簡単分類別
https://www.mhlw.go.jp/toukei/saikin/hw/jinkou/geppo/nengai18/dl/h6.pdf
注2)Livraghi L, Garber JE: PARP inhibitors in the management of breast cancer: current data and future prospects. BMC Med 13:188, 2015
研究手法と成果
共同研究グループはまず、バイオバンク・ジャパンで収集された早期発症の大腸がん患者196人、乳がん患者237人、前立腺がん患者215人、対照群389人の合計1,037人のサンプルについて全ゲノムシーケンス解析を行いました注3)。
次に、NCCNガイドラインに各疾患で遺伝学的検査の対象として指定されている遺伝子(大腸がん:12遺伝子、乳がん:11遺伝子、前立腺がん:9遺伝子で合計20遺伝子)について、病的バリアントを保有するかどうか解析しました。その結果、1,037人中63人(5.9%)に各個人に1個ずつの病的バリアントが見つかりました。そのうち、大部分の40個(63.5%)は一塩基バリアント(ゲノム配列の1塩基の違い)、17個(27.0%)は挿入・欠失[9]であり、残り6個(9.5%)は数千塩基以上のゲノム配列の欠失でした。また、これらの病的バリアントの1/3にあたる21個は、国際的データベースであるClinVar注4)、BRCAexchange注5)、InSiGHT注6)のどれにも含まれない、新しい病的バリアントでした。
さらに、各々のがんについて、どのような患者が病的バリアントを保有しているかを調べました。その結果、病的バリアント保有者の割合が最も高いのは乳がん14.8%(35人)、続いて大腸がん9.2%(18人)、前立腺がん3.7%(8人)の順であり、これらの割合は対照群0.5%(2人)に比べて有意に多いことが分かりました(図1)。この結果は、欧米人集団で行われた研究結果と類似しており注7-9)、NCCNガイドラインで指定されたがんの遺伝子を解析することが、日本人集団にも有用性を持つことが示されました。
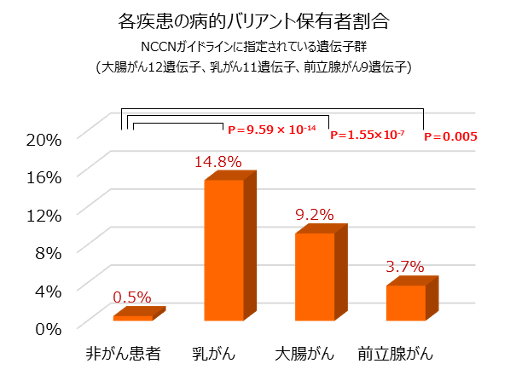
図1 NCCNガイドライン指定の遺伝子群における各疾患の病的バリアント保有者の割合
P値は、偶然にそのようなことが起こる確率のことで、統計学的有意差を示す指標である。P値が低いほど偶然では起こりえないことを表し、意味がある差だと考えられる。
注3) 2018年4月24日プレスリリース「全ゲノムシークエンス解析で日本人の適応進化を解明」の研究において、本研究で使用した全ゲノムシークエンスデータは使用されています。
https://www.riken.jp/press/2018/20180424_2/
注4) ClinVar:https://www.ncbi.nlm.nih.gov/clinvar/
注5)BRCAexchange :https://brcaexchange.org/
注6)InSiGHT :https://www.insight-group.org/
注7)Pritchard CC, Mateo J, Walsh MF, et al: Inherited DNA-Repair Gene Mutations in Men with Metastatic Prostate Cancer. N Engl J Med 375:443-53, 2016
注8)Buys SS, Sandbach JF, Gammon A, et al: A study of over 35,000 women with breast cancer tested with a 25-gene panel of hereditary cancer genes. Cancer 123:1721-1730, 2017
注9)Yurgelun MB, Kulke MH, Fuchs CS, et al: Cancer Susceptibility Gene Mutations in Individuals With Colorectal Cancer. J Clin Oncol 35:1086-1095, 2017
次に、病的バリアントが診断年齢やがん家族歴に関連するかどうかを調べました。その結果、病的バリアント保有者/非保有者の平均診断年齢は、大腸がんでは33.9歳/39.3歳、乳がんでは33.7歳/35.6歳であり、大腸がん・乳がんの保有者は非保有者よりも早期に診断されていることが分かりました。また同様に、病的バリアント保有者/非保有者の同じがん家族歴を持つ割合は、大腸がんでは64.7%/23.3%、前立腺がんでは50.0%/13.0%であり、大腸がん・前立腺がんの保有者は非保有者よりも同じがん家族歴を持つ割合が高いことが分かりました。また、前立腺がんの保有者/非保有者では、胃がん家族歴を持つ割合が50.0%/5.9%であり、前立腺がんの病的バリアント保有者は胃がん家族歴の割合が高いことが分かりました。
さらに、各々のがんの病的バリアントが見られた遺伝子の特徴を調べました。その結果、大腸がんでは、MSH2、MLH1、MSH6などのミスマッチ修復遺伝子[10]に病的バリアントを保有する患者が11人(5.6%)、家族性腺腫性ポリポーシス[11]の原因遺伝子であるAPCに病的バリアントを保有する患者が6人(3.1%)確認されました。また、数千塩基以上のゲノム配列の欠失が6人(3.1%)で確認され、そのうち4個がMSH2、MLH1などのミスマッチ修復遺伝子上にあり、2個がAPC遺伝子上にありました。一方、乳がんでは、BRCA1またはBRCA2に病的バリアントを保有する患者が26人(11.0%)確認され、乳がん患者の病的バリアント保有者(35人)のうち74.4%を占めていました。前立腺がんでも、1個の病的バリアントを除く7個がBRCA1またはBRCA2で同定されました。
最後に、NCCNガイドラインで指定された遺伝子以外にも、遺伝学的検査を行うべき遺伝子がないかを検証するために、がんの原因となる変異が報告されている遺伝子をまとめたCGCデータベースに登録されている遺伝子から合計98個の遺伝子(大腸がん:86遺伝子、乳がん:87遺伝子、前立腺がん:89遺伝子)を選択し解析を行いました。その結果、1,037人中42人(4.1%)に各個人1個ずつの病的バリアントが見つかりました。そして病的バリアント保有者の割合は、乳がん4.3%(10人)、大腸がん4.1%(8人)、前立腺がん7.9%(17人)であり、そのうち前立腺がんについては対照群1.8%(7人)と比べて有意に多く検出されたことが分かりました(図2)。また、前立腺がんの患者のうち、DNA修復に関連する遺伝子に病的バリアントを保有する患者が4.1%(9人)と多いことが分かりました。これは、前立腺がんではNCCNガイドラインの指定遺伝子以外の遺伝子も検査する必要があることを示しています。
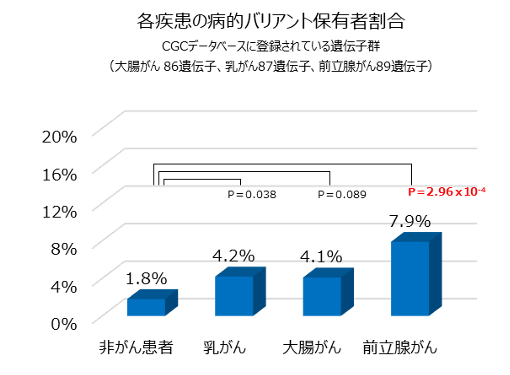
図2 CGCデータベースに登録された遺伝子群における各疾患の病的バリアント保有者の割合
図では、統計学的に有意差があるP値を赤の太字で示した。
今後の期待
本研究の成果により、NCCNガイドラインで指定された遺伝子が日本人集団にも有用であることや、前立腺がんにおいて日本人の遺伝学的検査の対象として拡張すべき遺伝子の候補が示されました。他のがん種についても、同様に大規模に解析を行うことで、日本人に合った遺伝学的検査の確立が期待されます。
論文情報
<タイトル>
Prevalence and spectrum of pathogenic germline variants in Japanese patients with early-onset colorectal, breast, and prostate cancer
<著者名>
Xiaoxi Liu, Sadaaki Takata, Kyota Ashikawa, Tomomi Aoi, Shunichi Kosugi, Chikashi Terao, Nicholas F. Parrish, Koichi Matsuda, Hidewaki Nakagawa, Yoichiro Kamatani, Michiaki Kubo, Yukihide Momozawa
<雑誌>
JCO Precision Oncology
<DOI>
用語解説
[1] 全ゲノムシークエンス解析
ヒトゲノムを構成する30億の塩基配列を解読するゲノム解析技術。
[2] オーダーメイド医療
個人の遺伝情報に基づき、1人1人に合った治療などを行うこと。
[3] 病的バリアント、遺伝子バリアント
ヒトのゲノム配列は約30億の塩基対からなる。その配列の個人間の違いを遺伝子バリアントという。
そのうち、疾患発症の原因となるものを病的バリアントと呼ぶ。
[4] NCCNガイドライン
全米を代表とするがんセンターで結成されたガイドライン策定組織である米国国立包括がんネットワーク(National Comprehensive Cancer Network)が作成する、世界的に広く利用されているがん診療ガイドライン。
(https://www.nccn.org/professionals/physician_gls/default.aspx)
[5] バイオバンク・ジャパン
日本人集団27万人を対象とした、世界最大級の疾患バイオバンク。
オーダーメイド医療の実現プログラムを通じて実施され、ゲノムDNAや血清サンプルを臨床情報と共に収集し、研究者へ分譲を行っている。
2003年から東京大学医科学研究所内に設置されている。 (https://biobankjp.org/)
[6] CGCデータベース
がんの原因となる変異やその遺伝子に関する報告がまとめられたデータベース。
The Cancer Gene Census (CGC) database (https://cancer.sanger.ac.uk/census)
[7] ゲノム配列
生物の設計図。アデニン(A)、チミン(T)、グアニン(G)、シトシン(C)の4種類の塩基が連なった塩基配列として、細胞内に保存されている。
ゲノム配列の長さは生物種によって異なり、ヒトにおいては約30億の塩基配列で構成されている。
[8] PARP阻害剤
DNAの相同組換え修復機構が機能していないがん細胞に、特異的に細胞死を誘導する新しい分子標的薬のこと。
PARPは、Poly(ADP ribose) polymeraseの略。
[9] 挿入・欠失
染色体または、DNAの塩基配列の一部が失われることを欠失、1塩基以上の配列が入り込むことを挿入と呼ぶ。
[10] ミスマッチ修復遺伝子
細胞分裂の際のDNA複製時に塩基の不対合(ミスマッチ)を修復する機能を担うタンパク質をコードしている遺伝子のこと。
[11] 家族性腺腫性ポリポーシス
APC遺伝子に存在する病的バリアントにより、大腸の多発性腺腫を主な症状とする疾患のこと。
