難治性血液がんに対する新しいエピゲノム治療の有効性と作用機序を解明―次世代技術と臨床研究の融合により日本発創薬のメカニズムを解明!―
- ヘッドライン
- 記者発表
東京大学
発表のポイント
◆日本で開発された新しいエピゲノム治療薬バレメトスタットが、治療が難しい血液がんのがん抑制遺伝子を回復させ、高い治療効果を示すことを証明しました。
◆メチル化ヒストンに対する阻害薬が人の体の中でどのように異常なエピゲノムを修正し、どのように薬剤耐性が発生するかを世界で初めて明らかにしました。
◆理論的根拠に基づいた創薬の成功により、同じ異常をもつ疾患への適切な医療の提供や治療拡大につながることが期待されます。
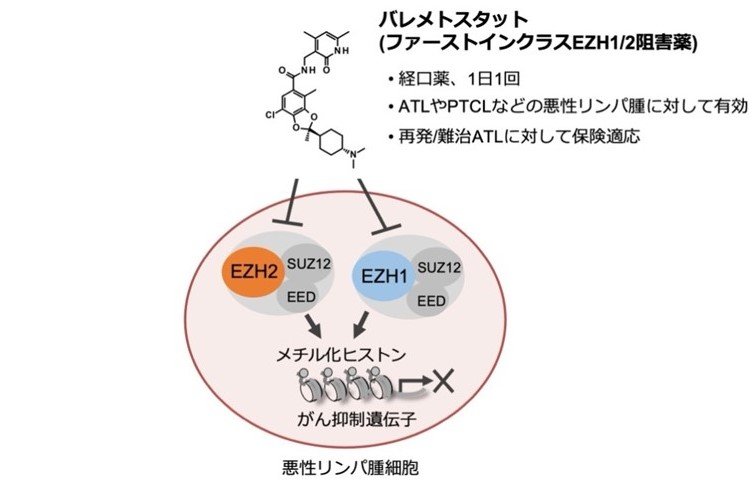
メチル化ヒストン阻害薬の作用機序
発表概要
東京大学大学院新領域創成科学研究科の山岸誠准教授、鈴木穣教授、内丸薫教授らによる研究グループは、エピゲノム異常(注1)に対する新しい阻害薬が多くのがん抑制遺伝子の発現を回復させ、治療の難しい血液がん患者に対して持続的な治療効果を示す分子メカニズムの解明に成功しました。
研究チームは、日本発の新薬であるメチル化ヒストン阻害薬バレメトスタット(注2)の治療を受けた成人T細胞白血病リンパ腫(ATL、注3)患者の体内でどのような変化が起こるかを、遺伝子発現とエピゲノムを同時に解析できる高精度の解析技術を組み合わせて詳細に検討しました。抑制されていた多くのがん抑制遺伝子の発現は治療開始後から徐々に正常化し、DNAに変異が多数蓄積した高悪性度のがん細胞の増殖を長期間抑制することを初めて観測しました。また長期治療後に発生しやすい薬剤耐性化のメカニズムも明らかにしました。
本成果は、日本発の創薬の成功を示しただけでなく、エピゲノム異常の修復が難治がんに有効である根拠とともに将来の課題に対する解決の糸口を示した点において、社会的意義が非常に大きいといえます。今後、同様の異常を持つ多くのがんに対する新しい治療法への応用が期待されます。
本成果は、英国科学雑誌『Nature』2024年2月21日版に掲載されました。
発表内容
がん細胞では、DNAが巻きつくヒストン分子がゲノム領域全体にわたって化学修飾を受け、近接する遺伝子が適切に働かないという根本的な特徴があります。特にヒストン分子の過剰なメチル化は、ゲノム上にコードされる多くのがん抑制遺伝子を一度に停止させるため、治療標的として有望視されていました。この度、本研究チームは新しい高解像度解析技術と臨床研究を融合させ、ヒストンメチル化酵素に対する阻害薬がヒトの体内でがん細胞のエピゲノム異常を修正し、難治性血液がんを縮小させる過程を世界で初めて観測しました。
これまで研究チームは、日本で患者が多く有効な治療法が確立されていない成人T細胞白血病リンパ腫(ATL)に注目し、エピゲノム異常とその原因分子EZH1、EZH2を同定していました。今回の研究では、EZH1/2阻害薬(バレメトスタット)の治療を実際に受けたATL患者の血液中の腫瘍細胞を治療前後で比較し、どのような変化が起こるかを詳細に検討しました(図1)。
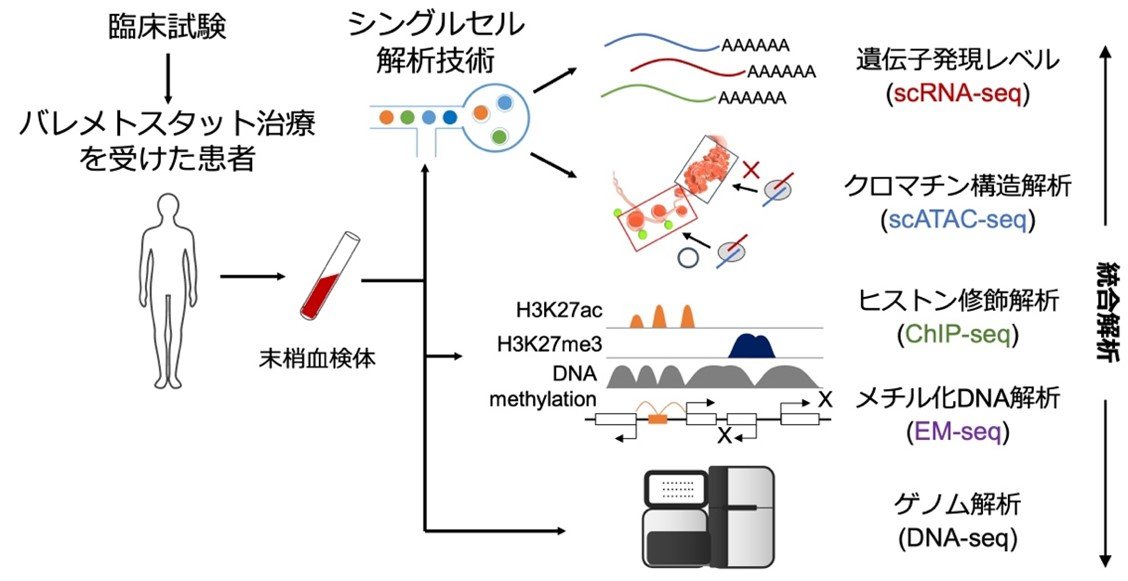
図1:研究の流れ
多彩な細胞集団のうち腫瘍細胞だけを高精度に解析できるシングルセル解析(注4)を行った結果、腫瘍細胞はDNAを取り巻くクロマチン構造(注5)がメチル化ヒストンによって異常に凝集し、多くのがん抑制遺伝子が発現できない状態に変化していることが判明しました。しかしバレメトスタットの投薬を受けた患者ではメチル化ヒストンが正常レベルまで低下し、凝集したクロマチン構造が徐々に緩むことで、数100種類のがん抑制遺伝子を一斉に回復させることが明らかになりました(図2)。
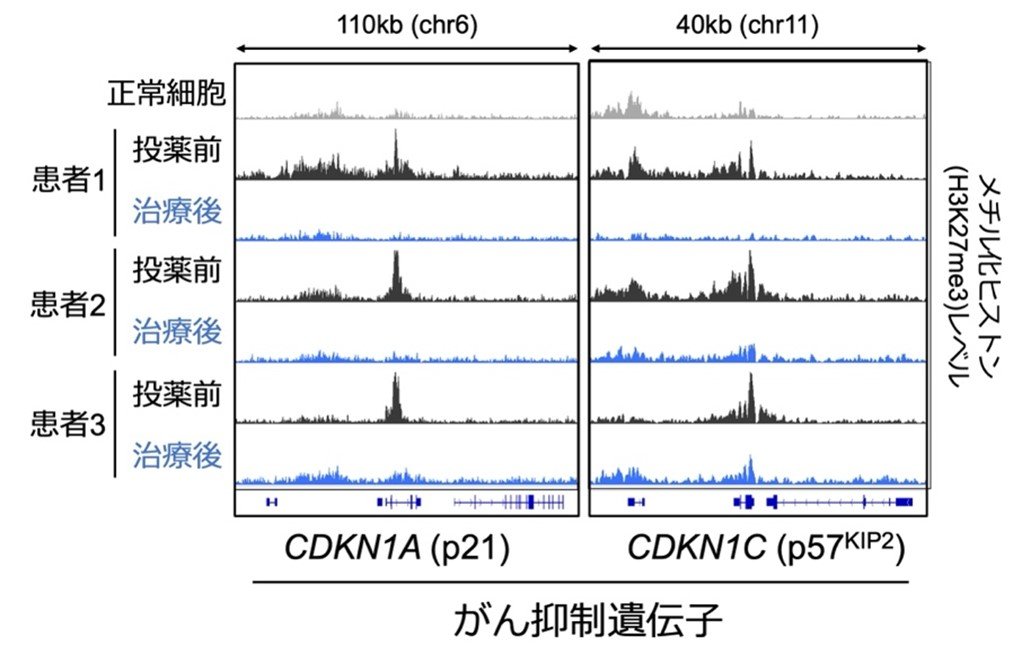
図2:バレメトスタットによるがん抑制遺伝子の活性化
投薬を受けた患者では、多くのがん抑制遺伝子周辺に蓄積したメチル化ヒストン(H3K27me3)が消失するため、がん抑制遺伝子の発現が回復する。
腫瘍細胞の薬剤に対する耐性化はがん治療で大きな課題です。研究グループは、バレメトスタット治療を長期間受けた患者から、薬剤耐性化した腫瘍細胞の出現を検出し、薬剤耐性に関わる遺伝子異常や、メチル化ヒストンの効果を代替する別の化学修飾が耐性化に関わることを突き止めました。さらに、投薬前の腫瘍細胞は、遺伝子翻訳活性や細胞代謝活性の異なる不均一な細胞で集団が構成されており、薬剤感受性と関わることを明らかにしました。これらの研究成果は、薬剤耐性化を回避し、より持続的な治療方法を開発していく上で極めて重要な発見です(図3)。
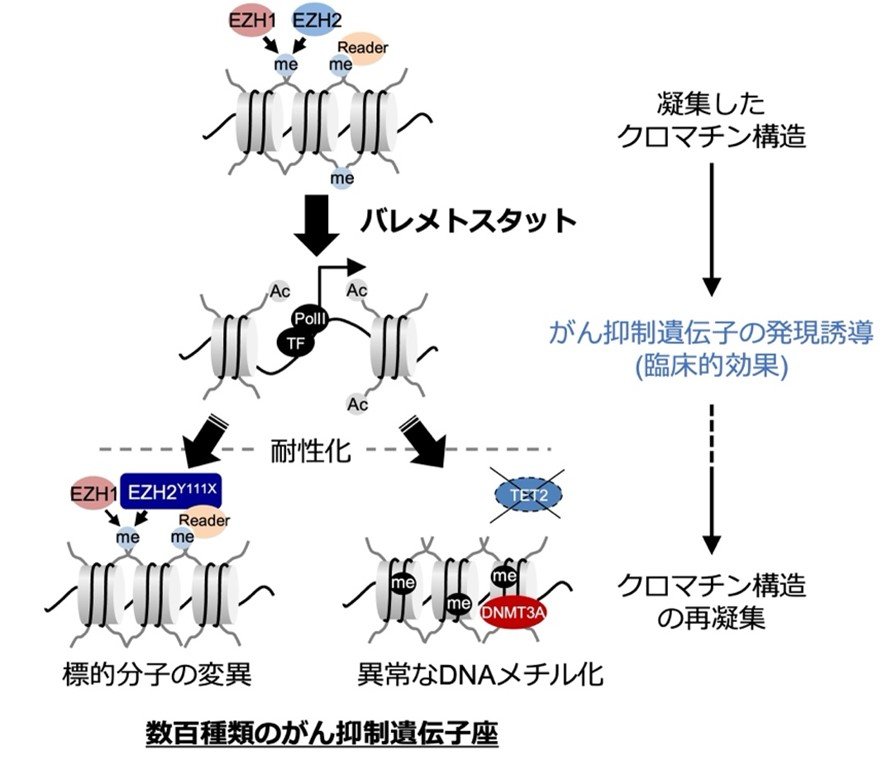
図3:バレメトスタットの作用機序と耐性化機序
バレメトスタットはEZH1/2の阻害によってメチル化ヒストンレベルを低下させ、がん抑制遺伝子の発現を誘導し、持続的な臨床的効果をもたらす。長期間投薬を受けた一部の患者では、標的分子の変異や、異常なDNAメチル化によってクロマチン構造が再凝集し、臨床的再発につながる。
本研究は、創薬の成功を示しただけでなく、可逆的なメチル化ヒストンががんに不可欠なドライバーであり、修正可能な治療標的として有望であるというコンセプトも示しました。今後、同様のエピゲノム異常を持つ様々ながん種に対する治療薬開発の促進や、エピゲノム創薬研究の発展に寄与することが期待されます。
〇関連情報:
プレスリリース「がん抑制遺伝子が不活性化される新たなメカニズムの発見」(2019/11/20)
https://www.k.u-tokyo.ac.jp/information/category/press/8152.html
<研究助成>
本研究は、日本医療研究開発機構(AMED)新興・再興感染症に対する革新的医薬品等開発推進研究事業「ゲノム情報を基盤としたHTLV-1感染症の病態形成機序の解明及び発症リスク予知アルゴリズム開発に関する総合的研究(23fk0108672)」(研究代表者 山岸誠)
日本医療研究開発機構(AMED)新興・再興感染症研究基盤創生事業(多分野融合研究領域)「HTLV-1 感染症のエピゲノムコードの解読と戦略的創薬を目指した基礎•臨床融合データサイエンス(23wm0325056)」(研究代表者 山岸誠)
日本医療研究開発機構(AMED)革新的がん医療実用化研究事業「シングルセルゲノミクスを用いたNOTCH変異クローンの特性解明及び新規治療法と層別化アルゴリズムの開発(21ck0106703)」(研究代表者 山岸誠)
科研費「基盤研究(C)(一般)(課題番号:22K08386)」及び「基盤研究(B)(一般)(課題番号:22H02987)」などの支援により実施されました。
発表者・研究者等情報
東京大学 大学院新領域創成科学研究科
山岸 誠 准教授
鈴木 穣 教授
内丸 薫 教授
論文情報
雑誌名:Nature
題 名:Mechanisms of action and resistance in histone methylation-targeted therapy
著者名:Makoto Yamagishi*, Yuta Kuze, Seiichiro Kobayashi, Makoto Nakashima, Satoko Morishima, Toyotaka Kawamata, Junya Makiyama, Kako Suzuki, Masahide Seki, Kazumi Abe, Kiyomi Imamura, Eri Watanabe, Kazumi Tsuchiya, Isao Yasumatsu, Gensuke Takayama, Yoshiyuki Hizukuri, Kazumi Ito, Yukihiro Taira, Yasuhito Nannya, Arinobu Tojo, Toshiki Watanabe, Shinji Tsutsumi, Yutaka Suzuki*, Kaoru Uchimaru*
DOI: 10.1038/s41586-024-07103-x.
URL: www.nature.com/articles/s41586-024-07103-x
用語解説
(注1)エピゲノム異常:
DNAの配列の変化を伴わない後天的な遺伝子発現の変化を誘導する分子メカニズムの異常。エピゲノムはDNAやそれを取り巻くヒストン分子の化学修飾の総称を指す。
(注2)バレメトスタット:
EZH1とEZH2に対する選択的経口阻害薬。バレメトスタットはEZH1とEZH2によるヒストンH3の27番目のリジン残基のメチル化(H3K27me3)を阻害することで、メチル化レベルを減少させ、近傍の遺伝子発現を上昇させる。2022年9月に再発難治性の成人T細胞白血病リンパ腫(ATL、注3)に対して製造販売が承認され、実臨床で使用されている。また他の様々な血液がんや固形がんに対する治療開発が進められ、世界中で臨床試験が実施されている。
(注3)成人T細胞白血病リンパ腫(ATL:Adult T-cell Leukemia-lymphoma):
ヒトT細胞白血病ウイルス1型(HTLV-1)感染者の約5%で発症する重篤な白血病リンパ腫。年間約1100人が発症し、ほぼ同数が毎年ATLで死亡している。有効な化学療法が確立しておらず、患者の約半数は発症後1年以内に死亡する。抗体療法、血液幹細胞の移植療法等が試みられている。
(注4)シングルセル解析:
細胞を1つずつ物理的に分離し、1細胞レベルで遺伝子の発現レベルやDNAの解析を行う技術。細胞集団の平均的な解析ではなく、個々の細胞の変化を動的に追うことで、少ない細胞集団や不均一な集団に対する高解像の解析が可能になる。本研究は、東京大学大学院新領域創成科学研究科附属生命データサイエンスセンター(LiSDaC)のサポートにより実施した。
(注5)クロマチン構造:
DNAがヒストンに巻きついた複合体。ヒストン分子の化学修飾(メチル化など)やDNAのメチル化によってクロマチン同士が凝集すると、DNAが立体構造的に他の分子からアクセスされにくくなるため、遺伝子の発現が抑制される。逆にクロマチン同士が互いに反発して構造が緩むと、遺伝子の発現が活発に起きる。
関連研究室
お問合せ