「白血病関連遺伝子ASXL1」が造血幹細胞での膜なし構造体の形成に関与
- ニュース
東京大学医科学研究所
東京大学大学院新領域創成科学研究科
発表のポイント
◆ヒストン修飾因子ASXL1はアミノ酸配列内に天然変性領域(IDR:intrinsically disordered region、注1)と呼ばれる構造を取りにくい領域を持ち、代表的な膜の無い構造体(Membraneless Organelles:MOs、注2)パラスペックル(注3)の形成を促進する性質を有することが分かりました。
◆一方、白血病の原因となる変異型ASXL1はこの機能を失っていることを明らかにしました。
◆パラスペックル構成因子のNONOが、造血幹細胞の機能に重要な役割を担っていることが分かりました。パラスペックルに着目することで、造血幹細胞の機能や白血病発症メカニズムの研究に新たな展望が開かれることが期待されます。
発表概要
生物の細胞内には脂質二重膜によって仕切られた構造体のほかにも、膜を持たない構造体MOsが多数存在しています。MOsは液-液相分離(LLPS:liquid-liquid phase separation、注4)によって細胞内に形成されることが知られています。近年になって、LLPSがMOsの形成をはじめとする細胞内の様々な現象に関わっていることがわかり、分子生物学におけるMOsやLLPS研究が活発に行われています。しかしながら、MOsの機能については未知の部分が多いことでも知られています。
東京大学医科学研究所 細胞療法分野の北村俊雄教授と東京大学大学院新領域創成科学研究科の合山進教授らのグループは、白血病原因遺伝子ASXL1のアミノ酸配列の中に、細胞内でLLPSが起きる上で重要な役割を担う天然変性領域(IDR)が存在することを見出し、ASXL1の新たな機能を明らかにしました。
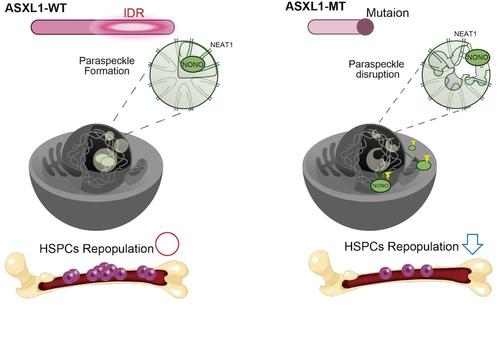
本研究では野生型ASXL1がC末端に存在するIDRを介して、LLPSを形成することを見出しました。一方でC末端のIDRを欠損した変異型ASXL1では、LLPSを形成しにくいことが分かりました。野生型ASXL1はLLPSによって形成されるMOsの一つである「パラスペックル」の形成を促進するのに対して、変異型ASXL1はこの機能を失っていることが明らかになりました。ASXL1変異を有するマウスの造血幹細胞においては、パラスペックルの形成障害が起きていました。パラスペックルの必須構成因子NONOをノックアウトした造血幹細胞では、機能障害が認められました。
これらの発見は、パラスペックルの形成が造血幹細胞の機能に重要な役割を担っていることを示しています。 パラスペックルをはじめとするMOsに着目することで、今までわからなかった造血幹細胞の機能や白血病発症メカニズムの研究に新たな展望が開かれることが期待されます。
野生型ASXL1と変異型ASXL1によるパラスペックル形成能の違い:
野生型ASXL1は造血幹細胞内においてパラスペックルの形成を促進する。一方で変異型ASXL1を有する造血幹細胞ではパラスペックルの形成障害が起こる。パラスペックルが正常に形成されない造血幹細胞においては、骨髄再構築能が低下する。
発表内容
生物の細胞内には「核」や「小胞体」「ミトコンドリア」など脂質二重膜によって仕切られた構造をもつオルガネラが存在しています。一方で細胞内には、膜を持たないMOsという構造体も多数存在しています。「パラスペックル」「核スペックル」「ストレス顆粒」などに代表されるこれら構造体は、LLPSによって細胞内に形成されています。LLPSとは水と油が分離するように、異なる組成の水溶液同士が互いに分離して液滴を形成する現象のことです。
細胞内で起こるLLPSには、IDRを有する蛋白質が重要な役割を担っています。IDRは決まった立体構造を持たないアミノ酸配列部位であり、その機能は長らく謎に包まれていました。近年になって、LLPSがMOsの形成をはじめとする細胞内の様々な現象に関わっていることがわかり、分子生物学におけるLLPS研究が盛んになっています。分子生物学におけるLLPSの研究はまだ発展途上であり、現在でもその多くは未解明です。
本研究室では白血病原因遺伝子ASXL1の研究を行っています。変異型ASXL1(ASXL1-MT)を発現するノックイン(KI)マウスを作成し、本マウスの機能解析を通じて白血病発症の分子メカニズムを研究してきました。また、過去には「ASXL1が変異獲得により、C末端側を欠損した変異型ASXL1を発現すること」を明らかにしました。変異型ASXL1はBAP1と協調して白血病発症を促進します。しかし、野生型と変異型ASXL1の蛋白質構造による機能の違いについては、まだ多くの研究の余地が残されていました。
本研究ではASXL1のアミノ酸配列に着目し、ASXL1がC末端側に長大なIDRを有することを見出しました。ASXL1のIDRは、変異によりその大部分が欠損してしまいます。ASXL1のC末端側にあるIDRは、他のエピジェネティック因子と比べても非常に長いものであり、ASXL1がLLPSに関与する蛋白質であることが示唆されました。人工合成したASXL1を用いた実験では、実際にASXL1がスライドガラス上で液滴を形成することが確認されました。過去の研究成果から、ASXL1がパラスペックルの構成因子と結合する可能性があることが分かっています。生化学的手法により、ASXL1とパラスペックル構成因子NONOとSFPQが、実際に細胞内で結合することが明らかになりました。また、野生型ASXL1がパラスペックルの形成に促進的に作用することが分かりました。
興味深いことに、変異型ASXL1は野生型ASXL1と比べてLLPSを起こす能力に劣り、パラスペックル形成を促進する機能も弱い、という性質が見出されました。そこで、ASXL1-MT-KIマウス由来の造血幹細胞を調べてみたところ、細胞内でパラスペックルの形成障害が起きていることが分かりました。パラスペックルを正常に形成できないことが、造血幹細胞の機能にどのような影響を及ぼすかを調べるため、CRISPR/Cas9システムを用いて造血幹細胞のNONOをノックアウトしました(注5)。NONOをノックアウトした造血幹細胞は、骨髄再構築能が低下しました。一方で、既にパラスペックルの形成障害が起きているASXL1-MT-KIマウスの造血細胞ではNONOのノックアウトをしても骨髄再構築能の低下は認められませんでした。
以上の発見は、パラスペックルの形成が造血幹細胞の機能に重要な役割を担っていることを示しています。MOsに着目することで、今までわからなかった造血幹細胞の機能や白血病発症メカニズムの研究に、新たな展望が開かれることが期待されます。
発表雑誌
雑誌名:「Cell Reports」(8月24日付けオンライン版)
論文タイトル:A histone modifier ASXL1 interacts with NONO and is involved in paraspeckle formation in hematopoietic cells
著者:Keita Yamamoto, Susumu Goyama, Shuhei Asada, Takeshi Fujino, Taishi Yonezawa, Naru Sato, Reina Takeda, Akiho Tsuchiya, Tomofusa Fukuyama, Yosuke Tanaka, Akihiko Yokoyama, Hikaru Toya, Ayana Kon, Yasuhito Nannya, Rena Onoguchi-Mizutani, Shinichi Nakagawa, Tetsuro Hirose, Seishi Ogawa, Nobuyoshi Akimitsu, and Toshio Kitamura*
DOI:10.1016/j.celrep.2021.109576
URL:https://www.cell.com/cell-reports/fulltext/S2211-1247(21)01010-X
発表者
北村 俊雄(東京大学医科学研究所 附属先端医療研究センター 細胞療法分野
/ 附属幹細胞治療研究センター 幹細胞シグナル制御部門 教授)
合山 進(東京大学大学院新領域創成科学研究科 メディカル情報生命専攻
先進分子腫瘍学分野 教授)
山本 圭太(東京大学医科学研究所 附属先端医療研究センター 細胞療法分野
/ 附属幹細胞治療研究センター 幹細胞シグナル制御部門 特任研究員)
用語解説
(注1)天然変性領域(IDR:intrinsically disordered region)
IDRは特定のアミノ酸の含有率が著しく偏った領域で、αヘリクス構造やβシート構造などのように固定された三次元構造を有さない領域を指す。IDRは決まった構造をとらずにフラフラとした状態で細胞内に存在していると考えられ、その機能については長らく議論の対象となってきた。しかし、近年になりLLPSの概念が分子生物学に普及するとともに、IDRを有する蛋白質が細胞内でLLPS現象を引き起こすことが分かり、注目を集めている。IDRはMOsに含有される蛋白質や転写・クロマチンリモデリング因子に多く見られることが知られている。
(注2)膜の無い構造体(Membraneless Organelles:MOs)
核や小胞体、ミトコンドリアなどの脂質二重膜に囲まれた細胞内小器官と対比して、膜構造を持たずに細胞内に存在する構造体を総称してMOsと呼称する。核内では「核小体」「核スペックル」「パラスペックル」など、細胞質では「ストレス顆粒」「P-body」「生殖顆粒」などが、代表的なMOsである。MOsは構成因子の液-液相分離によって形成される。
(注3)パラスペックル
パラスペックルは、核内に形成されるMOsの中でも最も代表的なものの一つである。同じく核内に存在するMOsの「核スペックル」に近接して存在することから「Para-speckle」と名付けられ、ともに核質のクロマチン間に存在する。パラスペックルの形成には、いくつかのRNA結合蛋白質と長鎖ノンコーディングRNAのNEAT1(Nuclear Enriched Abundant Transcript 1)が不可欠であることが知られている。パラスペックル形成に必須とされる構成蛋白質としてはNONOとSFPQが有名であり、これらはRNA制御に幅広く機能している。パラスペックルの機能の詳細は明らかになっていない部分も多いが、構成因子を隔離することで遺伝子発現制御に関わっていると考えられている。
(注4)液-液相分離(LLPS:liquid-liquid phase separation)
LLPSとは液滴形成の事で、分子生物学のみならず、工学や化学の分野でも共通して知られている基本的な物理現象である。水と油が分離するように異なる組成の水溶液同士が互いに分離して集合する性質であり、この力が細胞内でも働き、蛋白質が特定の領域に効率的に集まって機能したり、反対に望ましくない領域で働かないように隔離したりしている。LLPSによって細胞内の様々な現象が説明出来ることがわかり、近年分子生物学におけるLLPSの研究が盛んになっている。天然変性領域を有する蛋白質や核酸(RNA/DNA)は、細胞内でLLPS現象が起こるうえで重要な役割を担っている。
(注5)NONOはパラスペックルの必須構成因子であり、ノックアウトすることでパラスペックルが形成されなくなることが知られている。