健常な高齢者に潜む血液腫瘍の発症リスク「クローン性造血」の分子基盤を解明?造血器腫瘍関連遺伝子ASXL1の変異はDNA損傷を蓄積した造血幹細胞を異常に増殖させる?
- ニュース
東京大学医科学研究所
東京大学大学院新領域創成科学研究科
発表のポイント
◆ヒストン修飾因子ASXL1遺伝子の変異を起点としたクローン性造血の成因と、それに続発する造血器腫瘍への進展様式を明らかにしました。
◆ASXL1の変異体がシグナル伝達分子として果たす機能を新たに同定し、それがクローン性造血や造血器腫瘍を引き起こす分子基盤を明らかにしました。また、シグナル伝達経路を標的とした薬物の投与によって、クローン性造血が治療可能な病態であることが示唆されました。
◆クローン性造血は造血器腫瘍だけでなく、心血管疾患や脳血管疾患のリスクファクターであることから、その病態の解明や治療法の開発が必要とされています。本研究の結果は、クローン性造血の治療介入が可能であることを示唆しており、血液腫瘍や血管病変の予防的治療に道が開かれることが期待されます。
発表概要
一見健康に見える高齢者においても、遺伝子変異を有する造血細胞のコピーが加齢するにしたがって増えていき、血液がんの発症リスクが上昇することが最近になって明らかになってきました。この状態はクローン性造血(Clonal hematopoiesis: CH、注1)と呼ばれ、血液疾患に限らず、心筋梗塞や脳卒中のような血管病変のリスクも上昇させることから、その病態の解明や治療法の開発が課題となっています。CHではASXL1遺伝子(注2)の変異が高い頻度で検出されますが、それがなぜ造血細胞を増殖させ、がんの発症リスクを高めるのかはまだ分かっていませんでした。東京大学医科学研究所 細胞療法分野の北村俊雄教授と東京大学大学院新領域創成科学研究科の合山進教授らのグループは、造血系の加齢に伴うCHの成り立ちと、それが血液がんへ進展するメカニズムについて、ASXL1変異を有するマウスモデルを用いて明らかにしました。
本研究では、ASXL1の変異が細胞増殖シグナルを亢進させ、造血幹細胞(注3)を異常に増殖させることを示しました。また、その過程で生じる活性酸素がDNAを傷つけることを明らかにし、これが追加の遺伝子変異を誘発して発がんを促進することが示唆されました。薬物的に細胞増殖シグナルを阻害すると造血幹細胞の増殖が抑制され、活性酸素とDNA損傷を減少させることができました。これらの結果は、CHが治療可能な病態であることを示唆しており、血液がんや血管病変の予防的治療の開発に役立つことが期待されます。
発表内容
血液学的な異常が認められない健常な高齢者においても、体細胞変異を伴ったクローナルな造血が起こり、造血器腫瘍の発症リスクが上昇することが知られています。このような現象はCHと呼ばれ、血液疾患に限らず、心筋梗塞や脳梗塞のような血管病変のリスクも上昇させることから、その進展機序の解明は喫緊の課題となっています。特筆すべきことに、CHではDNMT3A, TET2, ASXL1を含むヒストン修飾因子(注4)の変異が高頻度に同定されます。DNMT3AおよびTET2欠失マウスの解析により、これらの変異を有する造血幹細胞では自己複製能が亢進し、造血細胞のクローナルな増殖が起こると考えられています。その一方、ASXL1変異を有するマウスモデルでは、造血幹細胞の機能はむしろ低下することが示されており、ASXL1の機能異常とCHの因果関係は解明されていませんでした。
そこで、本研究では変異型ASXL1(ASXL1-MT)を発現するノックイン(KI)マウスの解析を通じ、ASXL1変異がCHを惹起する分子機序の解明を試みました。若齢(12週)のASXL1-MT KIマウスでは、血液学的な異常は認められず、造血器腫瘍も発症しませんでした。骨髄中の造血幹細胞は減少し、既報と同様に移植後の骨髄再構築能(注5)は低下していました。次に、CHの頻度は加齢に伴って増加することから、生後約2年が経過した高齢マウスの解析を行いました。加齢したASXL1-MT KIマウスは、造血器腫瘍を発症しないものの、白血球の減少と貧血の進行が認められました。若齢マウスとは対照的に、造血幹細胞は顕著に増加していましたが、その骨髄再構築能は低下していました。さらに、ヒトで起こるCHにより近い条件でASXL1変異の影響を検討するため、Mx1-Creトランスジェニックマウス(注6)とASXL1-MT KIマウスを交配し、ASXL1-MTをモザイクに発現するマウスを確立しました。18か月の観察期間において、ASXL1-MT発現細胞は経時的に増加し、最終的に造血幹細胞分画を占拠するに至りました。これらの結果から、ASXL1-MTは機能が低下した異常な造血幹細胞を加齢に伴って増加させ、その集団を拡大させることが明らかとなりました。
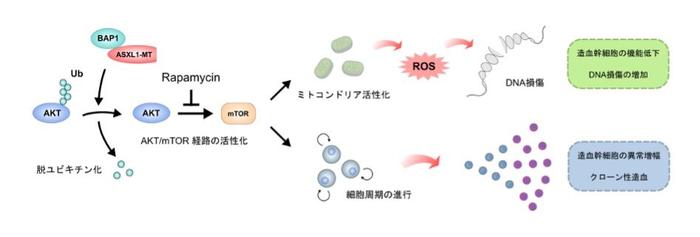
以上の病態を説明するメカニズムとして、ASXL1-MTが脱ユビキチン化酵素であるBAP1(注7)と協調し、AKTを脱ユビキチン化することを明らかにしました。安定化したAKTはAKT/mTOR経路を活性化し、造血幹細胞の細胞周期の進行とその増殖を促進しました。その一方、活性化したAKT/mTOR経路はミトコンドリアでの代謝亢進、活性酸素の増加、そしてDNA損傷の増加を引き起こしました。これは造血幹細胞の機能を低下させるだけでなく、ASXL1の変異自体が新たな遺伝子変異を惹起し、悪性化に寄与することを示唆する所見です。mTOR阻害薬であるラパマイシンを高齢マウスに投与すると、造血幹細胞の細胞周期は静止期に戻り、異常な増殖は抑制されました。さらに、ミトコンドリアの活性化、活性酸素の増加、DNA損傷の増加、そして造血再構築能の低下はすべてレスキューされました。したがって、AKT/mTOR経路の活性化は、ASXL1-MTによる造血幹細胞の機能異常の主要な原因であることが明らかになりました。
本研究により、ASXL1変異は造血再構築能の欠如した異常な造血幹細胞を増殖させることで、CHを引き起こすことが示唆されました。本来、ASXL1-MTはヒストン修飾を変化させることでその作用を発揮すると考えられてきましたが、それに加えてシグナル伝達経路に直接作用することで、病態形成に寄与することが明らかになりました。本研究の結果は、ASXL1変異を有するCHが治療可能な病態である可能性を示唆しており、造血器腫瘍の予防的治療に道が開かれることが期待されます。
発表雑誌
雑誌名:「Nature Communications」(3月23日付けオンライン版)
論文タイトル:Mutant ASXL1 induces age-related expansion of phenotypic hematopoietic stem cells through activation of Akt/mTOR pathway
著者:Takeshi Fujino*, Susumu Goyama, Yuki Sugiura, Daichi Inoue, Shuhei Asada, Satoshi Yamasaki, Akiko Matsumoto, Kiyoshi Yamaguchi, Yumiko Isobe, Akiho Tsuchiya, Shiori Shikata, Naru Sato, Hironobu Morinaga, Tomofusa Fukuyama, Yosuke Tanaka, Tsuyoshi Fukushima, Reina Takeda, Keita Yamamoto, Hiroaki Honda, Emi K. Nishimura, Yoichi Furukawa, Tatsuhiro Shibata, Omar Abdel-Wahab, Makoto Suematsu, and Toshio Kitamura*
DOI番号:https://doi.org/10.1038/s41467-021-22053-y
アブストラクトURL:https://www.nature.com/articles/s41467-021-22053-y
発表者
北村 俊雄
(東京大学医科学研究所 附属先端医療研究センター 細胞療法分野 / 附属幹細胞治療研究センター 幹細胞シグナル制御部門 教授)
(東京大学大学院新領域創成科学研究科 メディカル情報生命専攻 先進分子腫瘍学分野 教授)
藤野 赳至
(東京大学医科学研究所 附属先端医療研究センター 細胞療法分野 / 附属幹細胞治療研究センター 幹細胞シグナル制御部門 特任研究員)
用語解説
(注1)クローン性造血(Clonal hematopoiesis: CH)
造血細胞が遺伝子変異により増殖優位性を獲得し、それに由来する血液細胞がクローン性に増殖している状態のことをいう。この段階では腫瘍化に至っておらず、血液学的な異常は認められないが、造血器腫瘍の発症リスクは10倍に上昇する。さらに、心筋梗塞などの冠動脈疾患の発症頻度も上昇することから、造血系以外の多臓器に影響が及ぶ病態として注目されている。
(注2)ASXL1遺伝子
Polycomb repressive complex 2 (PRC2) と協調したヒストンH3K27のトリメチル化や、脱ユビキチン化酵素であるBAP1と協調したヒストンH2AK119の脱ユビキチン化を行い、ヒストン制御因子として遺伝子発現を調節する。その変異は、急性骨髄性白血病や骨髄異形成症候群を含む骨髄系腫瘍のうち10-20%の症例で認められるほか、DNMT3AやTET2とともにCHで最も頻度の高い遺伝子変異の一つであることが明らかになっている。
(注3)造血幹細胞
造血系では、自己複製能と多分化能を有する幹細胞が、分化の方向性が制限された様々な前駆細胞に分化し、最終的に成熟した血液細胞が産生される。造血幹細胞はこの階層構造の頂点に位置する少数の細胞集団であり、一生涯の造血を維持している。造血幹細胞に生じた遺伝子変異は造血器腫瘍や骨髄不全症の原因となるため、その遺伝的安定性の維持は極めて重要である。
(注4)ヒストン修飾因子
核内でDNAを巻きつけているヒストン分子は、メチル化、アセチル化、ユビキチン化などの修飾を受け、それにより遺伝子発現が調節されている。ヒストン修飾因子は、このようなヒストンの化学修飾を担い、遺伝子発現の制御に重要な役割を果たす。
(注5)骨髄再構築能
放射線照射を施したマウスをレシピエントとし、ドナー由来の造血細胞を移植したときに、造血系を再構築する能力のことをいう。実験的には、ドナー由来の造血幹・前駆細胞の機能を評価する目的で、しばしば用いられる指標である。
(注6)Mx1-Creトランスジェニックマウス
Mx1プロモーター制御下にCreリコンビナーゼを発現するよう設計されたマウスであり、インターフェロン応答によってCreの発現が誘導される。インターフェロン応答を誘導するポリイノシン・ポリシチジン(pIpC)の投与量を調整することで、一部の細胞で遺伝子変異が誘導されたモザイクマウスを作製することが可能である。
(注7)BAP1
脱ユビキチン化酵素としてはたらき、ASXL1と複合体を形成してヒストンH2AK119の脱ユビキチン化を行うことで、HOXA遺伝子群などの腫瘍関連遺伝子の発現を上昇させる。ASXL1変異体は、その酵素活性を異常に亢進させることが明らかになっている。また、K48やK63結合型のポリユビキチン鎖を脱ユビキチン化し、蛋白質の安定性やシグナル伝達に影響することも知られている。
添付資料
変異型ASXL1はDNA損傷を蓄積した造血幹細胞を異常に増殖させる:変異型ASXL1は脱ユビキチン化酵素BAP1の活性を亢進させてAKTを脱ユビキチン化する。安定化されたAKTはAKT/mTOR経路を活性化し、ミトコンドリアにおける代謝亢進、活性酸素種(ROS)の増加、DNA損傷の増加を引き起こし、造血幹細胞の機能を低下させる。その一方、細胞周期の進行を促進させ、造血幹細胞の異常な増殖も引き起こす。mTOR阻害薬であるRapamycinの投与により、これらの変化はレスキューされる。