教員検索
清宮 啓之
(せいみや ひろゆき/客員教授/生命科学研究系)
メディカル情報生命専攻/がん分子標的治療学分野/がん分子標的治療、テロメア、グアニン四重鎖、ポリADP-リボシル化、がん幹細胞

略歴
1990年3月 東京大学薬学部薬学科卒業
1995年3月 東京大学大学院薬学系研究科生命薬学博士課程修了(薬学博士)
1993年4月-1995年3月 日本学術振興会 特別研究員(がん)
1995年4月-2004年1月 (財)癌研究会癌化学療法センター基礎研究部 研究員
2000年1月-2001年10月 米国ニューヨーク大学医学部 博士研究員
2004年2月-2004年12月 (財)癌研究会癌化学療法センター基礎研究部 主任研究員
2005年1月 (財)癌研究会癌化学療法センター分子生物治療研究部 部長
(2011年4月改組 (公財)がん研究会がん化学療法センター分子生物治療研究部 部長)
2008年4月 明治薬科大学大学院薬学研究科 客員教授(兼務)
2009年8月 徳島大学大学院ヘルスバイオサイエンス研究部 客員教授(兼務)
2010年4月-2020年3月 東京大学大学院新領域創成科学研究科メディカルゲノム専攻 客員准教授(兼務)
2014年8月 横浜市立大学医学研究科 客員教授(兼務)
2018年5月 国立研究開発法人理化学研究所 創薬・医療技術基盤プログラム プロジェクトリーダー(兼務)
2020年4月 東京大学大学院新領域創成科学研究科メディカル情報生命専攻 客員教授(兼務)
教育活動
東京大学薬学部
慶應義塾大学大学院薬学研究科
広島大学大学院医系科学研究科
研究活動
1. テロメア動態とがん
細胞が分裂増殖するには自身のDNAを複製する必要がありますが、通常の仕組みではDNA鎖の両端(テロメアDNA)が完全には複製されず、徐々に失われていきます。テロメアはもともと染色体の末端を保護する役割を持っていますので、その短縮が限界に達すると、細胞はもはや分裂することが出来なくなります。細胞も老化する、というわけです。これは、私たちの身体の中で、異常な増殖性を持った細胞ががん化するのを未然に防ぐ仕組みのひとつとなっています。がん細胞では、テロメラーゼと呼ばれるテロメア合成酵素が活性化しており、テロメアが安定に維持されます。がん細胞が無限に分裂出来るのはこのためです。私たちはテロメラーゼ阻害剤の開発を進め、これらががん細胞の無限増殖を阻止することを実証してきました。最近は、テロメア非コードRNA(TERRA)によるがんの進展制御に関する基礎研究や、グアニン四重鎖と呼ばれる特殊な核酸高次構造を標的とした分子創薬研究を展開しています。
2. ポリADP-リボシル化による細胞制御
ポリADP-リボシル化(PAR化)は、タンパク質に最も大きな物性変化を与える翻訳後修飾の一つで、PARPと呼ばれる一群の酵素によって触媒されます。ゲノムの安定性や遺伝子発現をはじめ、様々な生物学的事象を調節する一方、ポリADP-リボース鎖の機能特異性を担保する仕組みなど、不明な点も多く残されています。近年、PARP阻害剤ががん抑制遺伝子BRCA1/2変異がんに対する合成致死性治療薬として認可されており、本酵素ファミリーは新たな分子標的シーズとして脚光を浴びています。私たちは、タンキラーゼと呼ばれるPARPに着目しています。タンキラーゼはテロメラーゼによるテロメアの維持を促進するのみならず、がんドライバーであるWnt/beta-cateninシグナルを正に制御します。私たちは、同シグナルを活性化したがんに対する革新的治療薬としてのタンキラーゼ阻害剤の開発や、同阻害剤の薬効を予測するバイオマーカーに関する研究を進めています。
3. がん幹細胞の治療抵抗性と標的分子
抗がん剤が効かない、あるいは最初は効いていたのにやがて効かなくなる現象を薬剤耐性と呼びます。これは腫瘍が可塑性および不均一性を備えたがん細胞集団で構成されていることによるとされています。がんの可塑性および不均一性は、確率論的なクローン進化に加え、がん幹細胞を最上位とする細胞階層性によってもたらされると考えられます。とりわけ、がん幹細胞は自己複製能・多分化能・強い造腫瘍性を保持し、薬剤や放射線に対する耐性および高い転移性を示すことから、がんの根治を阻む「女王蜂」的な存在として注目を集めています。私たちは、難治性の高い脳腫瘍である神経膠芽腫(グリオブラストーマ)のがん幹細胞や、日本人の罹患率が高い胃がんの患者由来がん幹細胞などに焦点を当て、機能ゲノミクスや網羅的遺伝子発現解析により、がん幹細胞の成り立ちや治療標的となる分子を追究しています
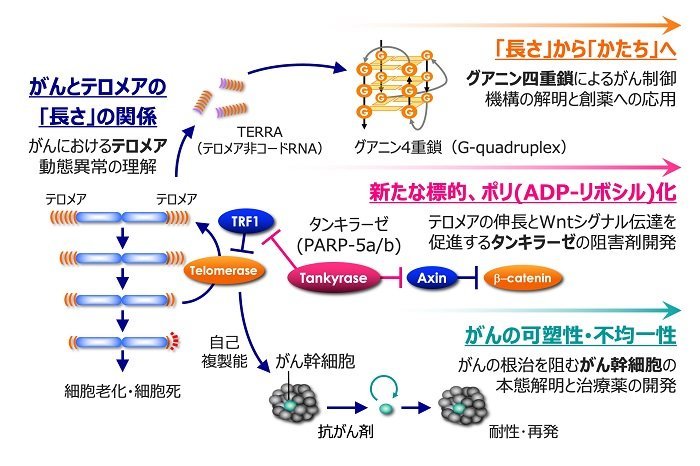
図1.テロメアを起点としたがんの本態解明と分子創薬
当研究室は、がん細胞の不老不死性と密接な関係にある染色体末端構造「テロメア」を出発点として、
グアニン四重鎖・ポリADP-リボシル化酵素・がん幹細胞に着目し、がんの本態解明と創薬応用を目指した研究を推進しています。
文献
1. Kawakami, R., Mashima, T., Kawata, N., Kumagai, K., Migita, T., Sano, T., Mizunuma, N., Yamaguchi, K., and Seimiya, H. (2020) ALDH1A3-mTOR axis as a therapeutic target for anticancer drug-tolerant persister cells in gastric cancer. Cancer Sci. 111, 962-973
2. Jang, M. K., Mashima, T., and Seimiya, H. (2020) Tankyrase inhibitors target colorectal cancer stem cells via AXIN-dependent downregulation of c-KIT tyrosine kinase. Mol. Cancer Ther. 19, 765-776
3. Mashima, T., Iwasaki, R., Kawata, N., Kawakami, R., Kumagai, K., Migita, T., Sano, T., Yamaguchi, K., and Seimiya, H. (2019) In silico chemical screening identifies epidermal growth factor receptor as a therapeutic target of drug-tolerant CD44v9-positive gastric cancer cells. Br. J. Cancer 121, 846-856
4. Okamoto, K., Ohishi, T., Kuroiwa, M., Iemura, S. I., Natsume, T., and Seimiya, H. (2018) MERIT40-dependent recruitment of tankyrase to damaged DNA and its implication for cell sensitivity to DNA-damaging anticancer drugs. Oncotarget 9, 35844-35855
5. Mizutani, A., Yashiroda, Y., Muramatsu, Y., Yoshida, H., Chikada, T., Tsumura, T., Okue, M., Shirai, F., Fukami, T., Yoshida, M., and Seimiya, H. (2018) RK-287107, a potent and specific tankyrase inhibitor, blocks colorectal cancer cell growth in a preclinical model. Cancer Sci. 109, 4003-4014
6. Fujiwara, C., Muramatsu, Y., Nishii, M., Tokunaka, K., Tahara, H., Ueno, M., Yamori, T., Sugimoto, Y., and Seimiya, H. (2018) Cell-based chemical fingerprinting identifies telomeres and lamin A as modifiers of DNA damage response in cancer cells. Sci. Rep. 8, 14827
7. Tanaka, N., Mashima, T., Mizutani, A., Sato, A., Aoyama, A., Gong, B., Yoshida, H., Muramatsu, Y., Nakata, K., Matsuura, M., Katayama, R., Nagayama, S., Fujita, N., Sugimoto, Y., and Seimiya, H. (2017) APC mutations as a potential biomarker for sensitivity to tankyrase inhibitors in colorectal cancer. Mol. Cancer Ther. 16, 752-762
8. Ohishi, T., Yoshida, H., Katori, M., Migita, T., Muramatsu, Y., Miyake, M., Ishikawa, Y., Saiura, A., Iemura, S. I., Natsume, T., and Seimiya, H. (2017) Tankyrase-binding protein TNKS1BP1 regulates actin cytoskeleton rearrangement and cancer cell invasion. Cancer Res. 77, 2328-2338
9. Nakamura, T., Okabe, S., Yoshida, H., Iida, K., Ma, Y., Sasaki, S., Yamori, T., Shin-Ya, K., Nakano, I., Nagasawa, K., and Seimiya, H. (2017) Targeting glioma stem cells in vivo by a G-quadruplex-stabilizing synthetic macrocyclic hexaoxazole. Sci. Rep. 7, 3605
10. Mashima, T., Taneda, Y., Jang, M. K., Mizutani, A., Muramatsu, Y., Yoshida, H., Sato, A., Tanaka, N., Sugimoto, Y., and Seimiya, H. (2017) mTOR signaling mediates resistance to tankyrase inhibitors in Wnt-driven colorectal cancer. Oncotarget 8, 47902-47915
11. Ouchi, R., Okabe, S., Migita, T., Nakano, I., and Seimiya, H. (2016) Senescence from glioma stem cell differentiation promotes tumor growth. Biochem. Biophys. Res. Commun. 470, 275-281
12. Hasegawa, D., Okabe, S., Okamoto, K., Nakano, I., Shin-ya, K., and Seimiya, H. (2016) G-quadruplex ligand-induced DNA damage response coupled with telomere dysfunction and replication stress in glioma stem cells. Biochem. Biophys. Res. Commun. 471, 75-81
13. Hirashima, K., and Seimiya, H. (2015) Telomeric repeat-containing RNA/G-quadruplex-forming sequences cause genome-wide alteration of gene expression in human cancer cells in vivo. Nucleic Acids Res. 43, 2022-2032
14. Ohishi, T., Muramatsu, Y., Yoshida, H., and Seimiya, H. (2014) TRF1 ensures the centromeric function of Aurora-B and proper chromosome segregation. Mol. Cell. Biol. 34, 2464-2478
15. Migita, T., Okabe, S., Ikeda, K., Igarashi, S., Sugawara, S., Tomida, A., Soga, T., Taguchi, R., and Seimiya, H. (2014) Inhibition of ATP citrate lyase induces triglyceride accumulation with altered fatty acid composition in cancer cells. Int. J. Cancer 135, 37-47
16. Mashima, T., Soma-Nagae, T., Migita, T., Kinoshita, R., Iwamoto, A., Yuasa, T., Yonese, J., Ishikawa, Y., and Seimiya, H. (2014) TRIB1 supports prostate tumorigenesis and tumor-propagating cell survival by regulation of endoplasmic reticulum chaperone expression. Cancer Res. 74, 4888-4897
17. Hirashima, K., Migita, T., Sato, S., Muramatsu, Y., Ishikawa, Y., and Seimiya, H. (2013) Telomere length influences cancer cell differentiation in vivo. Mol. Cell. Biol. 33, 2988-2995
18. Miyazaki, T., Pan, Y., Joshi, K., Purohit, D., Hu, B., Demir, H., Mazumder, S., Okabe, S., Yamori, T., Viapiano, M., Shin-ya, K., Seimiya, H., and Nakano, I. (2012) Telomestatin impairs glioma stem cell survival and growth through the disruption of telomeric G-quadruplex and inhibition of the proto-oncogene, c-Myb. Clin. Cancer Res. 18, 1268-1280
19. Deardorff, M. A., Bando, M., Nakato, R., Watrin, E., Itoh, T., Minamino, M., Saitoh, K., Komata, M., Katou, Y., Clark, D., Cole, K. E., De Baere, E., Decroos, C., Di Donato, N., Ernst, S., Francey, L. J., Gyftodimou, Y., Hirashima, K., Hullings, M., Ishikawa, Y., Jaulin, C., Kaur, M., Kiyono, T., Lombardi, P. M., Magnaghi-Jaulin, L., Mortier, G. R., Nozaki, N., Petersen, M. B., Seimiya, H., Siu, V. M., Suzuki, Y., Takagaki, K., Wilde, J. J., Willems, P. J., Prigent, C., Gillessen-Kaesbach, G., Christianson, D. W., Kaiser, F. J., Jackson, L. G., Hirota, T., Krantz, I. D., and Shirahige, K. (2012) HDAC8 mutations in Cornelia de Lange syndrome affect the cohesin acetylation cycle. Nature 489, 313-317
20. Seki, T., Yuasa, S., Oda, M., Egashira, T., Yae, K., Kusumoto, D., Nakata, H., Tohyama, S., Hashimoto, H., Kodaira, M., Okada, Y., Seimiya, H., Fusaki, N., Hasegawa, M., and Fukuda, K. (2010) Generation of induced pluripotent stem cells from human terminally differentiated circulating T cells. Cell Stem Cell 7, 11-14
21. Ohishi, T., Hirota, T., Tsuruo, T., and Seimiya, H. (2010) TRF1 mediates mitotic abnormalities induced by Aurora-A overexpression. Cancer Res. 70, 2041-2052
22. Mashima, T., Sato, S., Sugimoto, Y., Tsuruo, T., and Seimiya, H. (2009) Promotion of glioma cell survival by acyl-CoA synthetase 5 under extracellular acidosis conditions. Oncogene 28, 9-19
23. Seimiya, H., Muramatsu, Y., Ohishi, T., and Tsuruo, T. (2005) Tankyrase 1 as a target for telomere-directed molecular cancer therapeutics. Cancer Cell 7, 25-37
24. Seimiya, H., Muramatsu, Y., Smith, S., and Tsuruo, T. (2004) Functional subdomain in the ankyrin domain of tankyrase 1 required for poly(ADP-ribosyl)ation of TRF1 and telomere elongation. Mol. Cell. Biol. 24, 1944-1955
25. Motiwala, T., Kutay, H., Ghoshal, K., Bai, S., Seimiya, H., Tsuruo, T., Suster, S., Morrison, C., and Jacob, S. T. (2004) Protein tyrosine phosphatase receptor-type O (PTPRO) exhibits characteristics of a candidate tumor suppressor in human lung cancer. Proc. Natl. Acad. Sci. U. S. A. 101, 13844-13849
26. Seimiya, H., and Smith, S. (2002) The telomeric poly(ADP-ribose) polymerase, tankyrase 1, contains multiple binding sites for telomeric repeat binding factor 1 (TRF1) and a novel acceptor, 182-kDa tankyrase-binding protein (TAB182). J. Biol. Chem. 277, 14116-14126
27. Seimiya, H., Oh-hara, T., Suzuki, T., Naasani, I., Shimazaki, T., Tsuchiya, K., and Tsuruo, T. (2002) Telomere shortening and growth inhibition of human cancer cells by novel synthetic telomerase inhibitors MST-312, MST-295, and MST-199. Mol. Cancer Ther. 1, 657-665
28. Seimiya, H., Sawada, H., Muramatsu, Y., Shimizu, M., Ohko, K., Yamane, K., and Tsuruo, T. (2000) Involvement of 14-3-3 proteins in nuclear localization of telomerase. EMBO J. 19, 2652-2661
(総説・参考書)
1. Nakanishi, C., and Seimiya, H. (2020) G-quadruplex in cancer biology and drug discovery. Biochem. Biophys. Res. Commun., in press
2. Okamoto, K., and Seimiya, H. (2019) From the wings to the center stage of chromosomes. J. Biol. Chem. 294, 17723-17724
3. Okamoto, K., and Seimiya, H. (2019) Revisiting telomere shortening in cancer. Cells 8, 107
4. 清宮 啓之(編),進化するがん創薬 -がん科学と薬物療法の最前線,化学同人,2019年6月 (ISBN: 9784759817331)
5. 清宮 啓之,テロメア制御因子を標的とした革新的がん治療薬の開発,がん研究10か年戦略の成果と課題 -基礎から実用化までをつなぐ研究開発(堀田知光・宮園浩平 編),医学のあゆみ,271, 781-787,医歯薬出版,2019年11月
その他
日本癌学会:監事(2020年-)、評議員(2006年-)、利益相反委員(2014年~、2016~2019年 委員長)、International Session組織委員(2008-2017年)、国際委員(2015年-)、Cancer Science Associate Editor(2007年-)、Secretary for Editor-in-Chief(2002年-2008年)、第11回日米がん合同会議組織委員(2019年)
日本がん分子標的治療学会:理事(2014-2017年)、評議員、総務幹事、倫理・利益相反委員
日本臨床腫瘍学会:教育企画部会委員(2014-2019年)、新臨床腫瘍学(第4-6版)編集委員(2014年-)、用語小委員(2015-2018年)
文科省科研費新学術領域研究『先端モデル動物支援プラットフォーム(AdAMS)』:分子プロファイリング支援活動班長(2016年-)、若手支援技術講習会実行委員(2016年-)
医薬品医療機器総合機構(PMDA):専門委員(2013年-)、科学委員会 医薬品専門部会ワーキンググループメンバー(2013年)、非臨床試験の活用に関する専門部会委員(2015-2016年)
日本学術会議:連携会員、臨床医学委員会 腫瘍分科会 幹事(2017年-)
日本学術振興会:専門委員(2011年他)、科研費審査委員表彰(2017年)
文科省科研費新学術領域研究『がん研究分野の特性等を踏まえた支援活動』:化学療法基盤支援活動班員(2010~2014年)、班長(2015年)、がん若手研究者ワークショップ実行委員(2011-2015年)
がん研究会国際がん化学療法シンポジウム(JFCR-International Symposium on Cancer Chemotherapy):Executive Member, Committee Member(2007年-)
抗悪性腫瘍薬開発フォーラム:幹事・実行委員(2006年-)
名古屋癌治療国際シンポジウム:Advisor(2013年-)
関東ホルモンと癌研究会:幹事(2008年-)、第20回研究会当番幹事(2020年)
日本RNAi研究会:役員(2009年-)
日本分子生物学会
日本薬学会
米国癌学会(AACR)
Journal of Biological Chemistry, Editorial Board Member(2017年-)
Frontiers in Cancer Molecular Targets and Therapeutics, Review Editor(2011年-)
Journal of Cancer Research and Clinical Oncology (Editorial Board)
Gene Expression (Editorial Board)
将来計画
当研究室の達成目標は、がん特有のアキレス腱を分子レベルで理解すること、そしてそれらを「分子標的」とした有効ながん治療法を開発すること。具体的には、細胞の分裂寿命に関わる「テロメア」、ゲノムの安定性などに寄与する「ポリADP-リボシル化酵素」、がんの発生と再発に関わる「がん幹細胞」に着目しています。これらのシステム異常の分子基盤を明らかにし、その矯正・遮断による制がんを目指します。
教員からのメッセージ
ヒト正常細胞を培養して、増殖がだんだんと弱まっていくさまを眺めていると、ああ、人生は一度きりなんだなぁ、と妙に納得してしまいます。一度きりの人生をいかに充実させるかを意識し始めると、思考や行動が自ずと主体的になってきます。主体的な思考と行動、それは研究に必須な要素であるばかりでなく、人心をも動かすものだと思います。
ホームページのURL
http://www.jfcr.or.jp/chemotherapy/department/molecular_biotherapy/
